ВВЕДЕНИЕ
Целью систем доставки лекарств является обеспечение желаемой концентрации лекарственного вещества (ЛВ) в определенном месте для достижения терапевтического эффекта.
Твердые пероральные лекарственные формы (ЛФ) наиболее предпочтительны для приема внутрь в связи с преимуществами, которые включают простоту применения, легкость транспортировки, возможность управлять профилем высвобождения ЛВ и высокой стабильностью [2, c. 1]. Однако обычные твердые ЛФ могут вызывать колебания концентрации лекарственного средства (ЛС) в плазме, что может привести к снижению терапевтической эффективности, увеличению частоты дозирования и/или привести к побочным или токсическим эффектам, что будет отрицательно влиять на комплаенс пациента. Основная цель ЛФ с контролируемым высвобождением состоит в том, чтобы уменьшить или избавиться от недостатков, возможных в обычных ЛФ, улучшить соблюдение пациентом режима лечения через снижение частоты дозирования; или повысить эффективность лекарственного средства за счет локализации в месте воздействия [14, c. 2]. Как моно-, так и многокомпонентные ЛФ с различными профилями высвобождения разрабатывались для получения желаемого фармакологического эффекта и уменьшения колебаний концентрации [7, c. 1].
В настоящее время, в связи с увеличением затрат и осложнений, большое внимание уделяется разработке систем контролируемой доставки лекарств, в том числе и для перорального применения.
ИСТОРИЯ ТЕХНОЛОГИЙ ДОСТАВКИ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ
Самая ранняя работа в области развития систем доставки лекарств появилась в патенте Israel Lipowski в1938 г., где были получены покрытые гранулы пролонгированного высвобождения [6, с. 1], однако история разработки лекарственных форм с замедленным высвобождением восходит к началу 1950-х гг., когда был представлен подход с использованием покрытых частиц для замедленной доставки лекарств [3, c. 1].
До 1950 г. все ЛП получали в виде таблеток или капсул, которые высвобождали действующее вещество сразу после контакта со средой желудочно-кишечного тракта (ЖКТ), без какой-либо возможности контролировать кинетику этого процесса. В 1952 г. Smith Klein Beecham представил первый состав с замедленным высвобождением, который был способен контролировать кинетику высвобождения ЛВ и обеспечивать 12-часовую эффективность [16, c. 2]. Эта технология была известна как технология Spansule, и она позволяла контролировать кинетику высвобождения ЛВ с определенной скоростью. Однако, когда началась новая технология контролируемой доставки лекарств, разные термины использовались для описания новых составов, имеющих незначительные отличия друг от друга. Составы с контролируемым высвобождением включали препараты с замедленным высвобождением, отсроченным, т. е. приуроченным к определенному промежутку времени выхода ЛВ, пролонгированным высвобождением и другие, в которых термин «замедленное высвобождение» использовался более широко, чем другие. По мнению Yeon Hee Yun (2015), в настоящее время эти термины используются как синонимы, поскольку небольшие различия в функциях, которые они влекут за собой, стали ненужными из-за огромного прогресса в технологиях доставки лекарств.
Большая часть фундаментального понимания механизмов высвобождения ЛВ была получена во время разработки систем доставки первого поколения (G1) с 1950 по 1980 г. В этот период были выявлены четыре механизма высвобождения ЛВ, которые ускорили разработку многочисленных пероральных и трансдермальных препаратов с контролируемым высвобождением. Наиболее широко применяемыми механизмами были системы с контролируемым растворением и контролируемой диффузией. Составы на основе осмоса приобрели временную популярность, но количество этих продуктов на порядки меньше, чем у первых двух. Механизм ионного обмена отличается от других, но он бесполезен без сочетания с механизмом контролируемой диффузии. Даже сегодня многие пероральные препараты для приема один раз в день разрабатываются на основе механизма, контролируемого растворением или диффузией.
Технологии второго поколения G2 (1980–2010), в отличие от G1, были менее успешными, если судить по количеству произведенных клинических продуктов. Это может быть связано с тем, что технологии G2 были направлены на более сложные составы. Например, препараты депо для инъекций, изготовленные из биоразлагаемого полимера (молочно-гликолевая кислота), предназначены для доставки пептидных и белковых лекарственных средств в течение месяца или дольше [15, c. 1]. Однако трудно контролировать первоначальное взрывное высвобождение, которое часто высвобождает в первые один или два дня 50 % от общего количества ЛС. В течение периода G2 также были разработаны легочные системы доставки инсулина, но его более низкая биодоступность требовала доставки в несколько раз большего количества инсулина, чем требуется для парентеральной инъекции. Это, в свою очередь, привело к неожиданным побочным эффектам, которые, наряду с другими факторами, вызвали изъятие продукта с рынка. Для поиска альтернативных решений на протяжении многих лет разрабатывались различные саморегулирующиеся системы доставки инсулина [13, c. 1, 2]. Саморегулирующиеся системы доставки инсулина достаточно хорошо работают в лабораторных условиях, но они теряют свою функцию вскоре после имплантации in vivo. Последнее десятилетие периода G2 было сосредоточено на нацеленную на опухоль доставку ЛВ с использованием наночастиц. Наночастицы показали уникальность в адресной доставке лекарств к опухолям. Наночастицы были успешны в моделях ксенотрансплантатов мелких животных, но их применение в клинических условиях было очень редким [8, c. 2, 3].
ОРАЛЬНЫЕ ФОРМЫ КОНТРОЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ
В зависимости от условий высвобождения лекарства эти системы можно классифицировать следующим образом:
1. Системы непрерывного высвобождения: они высвобождают ЛВ в течение длительного периода времени по всей длине из ЖКТ с нормальным прохождением ЛФ [4, c. 3] и подразделяются на следующие категории:
• А. Системы с контролируемой диффузией;
• Б. Системы с контролируемым высвобождением при растворении;
• В. Системы с контролируемым высвобождением при растворении и диффузии;
• Г. Ионообменная смола — лекарственные комплексы;
• Д. pH-независимые комплексы.
2. Системы отложенного транзита и непрерывного высвобождения предназначены для продления срока их нахождения в ЖКТ с одновременным высвобождением. ЛФ предназначена для задержания в желудке, и, следовательно, присутствующее на нем покрытие должно быть устойчиво к pH на различных уровнях ЖКТ. Примером подобных систем являются мукоадгезивные системы [11, c. 14–15].
3. Системы отсроченного высвобождения, где ЛВ высвобождается только на определенном уровне ЖКТ. Эти системы содержат препараты, которые:
• могут вызвать расстройство желудка;
• разрушаются в желудке или кишечными ферментами;
• предназначенные для увеличения местного эффекта на определенном участке ЖКТ;
• всасываются из определенного участка кишечника [5, c. 2];
• к системам отсроченного выпуска относятся:
• высвобождающие в тонком кишечнике,
• высвобождающие в толстой кишке.
Пероральную контролируемую доставку лекарств можно также разделить на две группы, по форме индивидуальной дозы: single unit (на пример, таблетки и капсулы) и multiple unit ЛФ, где в первом опорожнение желудка очень вариабельно и зависит от статуса питания, и абсорбция показывает вариабельность внутри и между отдельными людьми. Также они имеют высокий риск передозировки и местного раздражения. Напротив, при применении multiple unit ЛФ опорожнение желудка более предсказуемо и в меньшей степени зависит от статуса питания. Абсорбция бывает без вариабельности внутри и между отдельными людьми, и риск передозировки и местного раздражения низкий. К этой группе относятся мини-таблетки, гранулы и пеллеты.
ФАРМАЦЕВТИЧЕСКИЕ ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ДИЗАЙН СИСТЕМ ДОСТАВКИ ЛЕКАРСТВ С МОДИФИЦИРОВАННЫМ ВЫСВОБОЖДЕНИЕМ
A. Физико-химические свойства лекарственного вещества [9, с. 4, 5]
Молекулярный размер и диффузия: коэффициент диффузии ЛФ с молекулярной массой 100–400 Да через гибкий диапазон полимера составляет 10–6–10–9 см2/с. ЛФ с молекулярной массой более 500 Да имеют коэффициент диффузии во многих полимерах менее 10–12 см2/с.
Кажущийся коэффициент распределения (P (O/W)): чем выше кажущийся коэффициент распределения молекул ЛВ, тем больше его липофильность и, следовательно, больше составляет его скорость и степень поглощения. Этот параметр является значительным при определении скорости выхода ЛВ от липофильной матрицы. ЛВ, которые имеют более низкий коэффициент распределения, не подходят для пероральных систем доставки лекарств с модифицированным высвобождением, как и те лекарства, которые имеют более высокий коэффициент распределения, потому что не отделяются от липидной мембраны, как только они попадают в мембрану.
рKA и ионизация при физиологическом pH: скорость поглощения ионизированного ЛВ в 3–4 раза меньше, чем у неионизированного ЛВ. Поэтому ЛВ, которые существуют в основном в ионизированной форме, являются плохими кандидатами для пероральных лекарственных форм с пролонгированным высвобождением (ЛФПВ).
Стабильность лекарства: ЛВ подвергаются как кислотно-щелочному гидролизу, так и ферментативному расщеплению при пероральном введении. Если препарат вводят в виде ЛФПВ, которые нестабильны в тонкой кишке, может наблюдаться снижение биодоступности. Это связано с доставкой большего количества препарата в тонкую кишку и его большей деградацией.
Растворимость в воде: ЛВ с хорошей растворимостью, особенно если она не зависит от рН, служит хорошим кандидатом для формирования ЛФПВ. Нижний предел растворимости молекул препаратов, подходящих для таких ЛФ, составляет 0,1 мг/мл. Растворимость, зависящая от рН, особенно в физиологическом диапазоне рН, была бы еще одной проблемой для разработки ЛФПВ из-за изменений в pH по всему ЖКТ и изменению скорости растворения. Растворимость ЛВ может также ограничить выбор механизма, который будет использоваться в ЛФ с модифицированным высвобождением, например диффузионные системы не подходят для плохо растворимых ЛВ. Препарату с высокой растворимостью и быстрой скоростью растворения часто трудно замедлять высвобождение, особенно когда доза высока.
Б. Фармакокинетические характеристики лекарственного вещества [10, c. 4]
Скорость поглощения: ЛВ с медленной абсорбцией является плохим кандидатом для ЛФПВ, поскольку непрерывное высвобождение приведет к образованию пула неабсорбированного ЛВ.
Скорость метаболизма: активно метаболизирующиеся препараты подходят для ЛФПВ, если скорость метаболизма не слишком высока.
Период полувыведения: препараты с периодом полувыведения от 2 до 4 часов являются хорошими кандидатами для ЛФПВ.
Указатель лекарственных форм: он определяется как отношение Css, max до Css, min. Цель ЛФПВ состоит в том, чтобы улучшить терапию за счет снижения индекса лекарственной формы при поддержании уровня ЛВ в плазме в пределах терапевтического окна.
В. Фармакодинамические характеристики лекарственного вещества [12, c. 5–6]
Доза препарата: максимальная сила дозы для ЛФПВ обычно составляет 1 г.
Терапевтический диапазон: ЛВ, которые будут формулированными в ЛФПВ, должны иметь широкий терапевтический диапазон.
Терапевтический индекс: препараты с узким терапевтическим индексом — это препараты с небольшой разницей между их терапевтической и токсической дозами, т. е. небольшие изменения в дозировке могут быть опасными. Такие препараты не подходят для включения в составы с замедленным высвобождением из-за риска демпинга дозы, что приводит к токсичности.
Отношение концентрации в плазме к ответу: концентрация препарата в плазме, как правило, более ответственна за фармакологическую активность, чем доза. Препараты, обладающие фармакологической активностью, не зависящей от концентрации в плазме, являются плохим кандидатом для пероральной ЛФПВ.
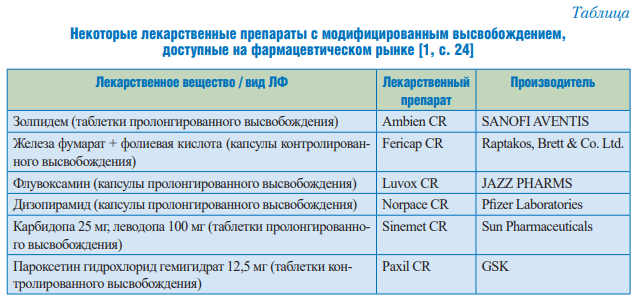
Некоторые примеры доступных на рынке ЛФ с модифицированным высвобождением приведены в таблице.
ЗАКЛЮЧЕНИЕ
Разработка лекарственных форм с модифицированным высвобождением остается актуальным направлением фармацевтической разработки, обусловленной появлением в медицинской практике новых веществ, а также повышением требований безопасности и комплаенса применения известных препаратов.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов при написании статьи.
CONFLICT OF INTEREST
The authors declare that there is no conflict of interest.


