Актуальность
Социально-экономическое значение ХЗВ сложно переоценить [1–3]. Наличие стволового рефлюкса отягощает объективные и субъективные проявления заболевания, снижает качество жизни, что определяет необходимость его хирургической коррекции [4–6]. На сегодняшний день существуют открытые хирургические (кроссэктомия и стриппинг) и чрескожные малоинвазивные методы коррекции рефлюкса. Последние принято делить на термические тумесцентные (ТТ, лазерная, радиочастотная, паровая облитерация) и нетермические нетумесцентные (НТНТ, склеротерапия, механохимическая облитерация, клеевая облитерация).
Облитерация сафенных вен цианакрилатным клеем является относительно немолодым методом купирования стволового рефлюкса, первый опыт применения которого в России датируется периодом 1995–2002 гг. [7]. Однако появление в последние годы новых рецептур клеевых композиций и методов их доставки обусловило увеличение интереса к названной методике. На сегодняшний день единственным зарегистрированным методом цианакрилатной облитерации (ЦАО) подкожных вен является технология VenaSeal (Medtronic, США). Ее преимуществом является отсут ствие потребности в тумесцентной анестезии, низкий уровень интраоперационной и послеоперационной боли, минимальная выраженность внутрикожных кровоизлияний, высокий рейтинг окклюзии, не отличающийся от такового при радиочастотной облитерации (РЧО), отсутствие потребности в компрессионной терапии после вмешательства, а также высокая частота самостоятельной инволюции варикозных притоков без выполнения склеротерапии или минифлебэктомии, что определяет быструю реабилитацию пациентов и возврат к трудовой деятельности и повседневной активности [8–10]. Недостатками технологии считаются относительно высокая частота воспалительных изменений кожи и мягких тканей в проекции вены, а также отсутствие резорбции клеевой композиции на протяжении многих лет.
Целью исследования является оценка эффективности и безопасности применения цианакрилатной облитерации сафенных вен по технологии VenaSeal при лечении варикозной болезни нижних конечностей.
Материал и методы
Для достижения поставленной цели на базе АО «МСЧ «Нефтяник»» (г. Тюмень) с декабря 2017 г. по сей день продолжается проспективное наблюдательное исследование, дизайн которого был одобрен Локальным этическим комитетом ФГБОУ ВО «Тюменский медицинский университет» Минздрава России. Критериями включения в исследование являются: варикозная болезнь нижних конечностей, соответствующая клиническому классу С2 и выше по классификации СЕАР; наличие рефлюкса по стволу БПВ и (или) МПВ длительностью более 0,5 секунд; подписанное информированное согласие. Критериями исключения являются: техническая невозможность или отказ пациента от выполнения ЦАО; беременность и лактация; поливалентная аллергия; перенесенный ранее тромбоз поверхностных или глубоких вен; ожидаемая низкая комплаентность; отказ от участия в исследовании.
Клеевая облитерация проводится по технологии VenaSeal в соответствии с описанной ниже методикой. После выполнения местной инфильтрационной анестезии кожи под ультразвуковой навигацией осуществляется пункция вены катетером на игле размером 16G, через который в просвет сосуда вводится J-образный проводник и позиционируется в области сафенофеморального соустья (СФС). По проводнику в вену заводится дилататор и интродьюсер размером 7F, который также позиционируется в зоне соустья строго на расстоянии 5 см от бедренной вены, измеренном по задней (нижней в горизонтальном положении тела) стенке ствола БПВ, после чего проводник извлекается из сосуда.
Шприц из набора VenaSeal заполняется цианакрилатной композицией (3 мл) с обязательным удалением всех пузырьков воздуха, присоединяется к катетеру доставки и вставляется в пистолет-диспенсер. Для фиксации шприца в диспенсере его следует повернуть на четверть оборота по часовой стрелке, предварительно подтянув шток и нажав на верхнюю кнопку пистолета. После нажатия на рычаг клей заполняет катетер доставки до уровня дистальной лазерной насечки. Затем катетер вводится в интродьюсер до уровня проксимальной лазерной насечки, интродьюсер извлекается на 5 см, что позволяет соединить его с катетером доставки с помощью специального замка. Выполняется ультразвуковой контроль расположения кончика катетера в области соустья с возможной коррекцией его позиции так, чтобы расстояние до бедренной вены составляло строго 5 см.
С помощью ультразвукового датчика производится компрессия ствола БПВ выше катетера на расстоянии не менее 2 см от соустья, вводится 0,1 мл клея путем нажатия на диспенсер в течение 3 секунд, катетер вытягивается на 1 см и повторно вводится 0,1 мл клея аналогичным образом, после чего катетер вытягивается на 3 см и производится компрессия обработанного сегмента вены свободной рукой параллельно с продолжающимся прижатием приустьевого сегмента датчиком на протяжении 3 минут. Затем вводится еще 0,1 мл клея и катетер вытягивается на 3 см с последующей компрессией обработанного сегмента датчиком на протяжении 30 секунд. Процедура продолжается по ходу всего целевого участка вены, пока из места пункции не покажется кончик интродьюсера и катетер доставки, после чего выполняется его извлечение из просвета сосуда, локальная компрессия места пункции с последующим наложением асептической повязки.
Эластичная компрессия чулком 2 класса стандарта RAL-GZ 387 (давление 23–32 мм рт. ст. в области лодыжки) рекомендуется в дневном режиме на протяжении 3–6 недель в случае выполнения склеротерапии или при наличии выраженных веноспецифических симптомов и признаков. Склеротерапия варикозных притоков выполняется сразу после вмешательства или в отсроченном периоде при отсутствии самостоятельной инволюции вен и (или) сохранении вено-специфических симптомов. Для этого используется пенная форма склерозанта на основе 1,0–3,0 % раствора Полидоканола или Тетрадецилсульфата, приготовленная по методике Tessari [11].
Клиническая и ультразвуковая оценка результатов осуществляется перед вмешательством и после вмешательства на запланированных визитах через 1 неделю, 1, 3, 6, 12 месяцев после вмешательства и далее ежегодно. Клиническая оценка включает определение класса ХЗВ по СЕАР и тяжести заболевания по VCSS [1]. Ультразвуковое исследование выполняется по стандартной методике с оценкой глубоких вен в горизонтальном или сидячем положении тела, поверхностных вен — в положении стоя. Проба Вальсальвы и мануальная дистальная компрессионная проба служат для оценки состоятельности венозных клапанов в проксимальном отделе (сафено-феморальное соустье, бедренная вена); дистальная мануальная компрессионная проба и проба с имитацией ходьбы — для оценки клапанной состоятельности более дистальных сегментов поверхностных и глубоких вен. Патологическим считается рефлюкс длительностью более 1,0 сек на бедренной и подколенной венах, более 0,5 сек — на всех подкожных венах и дистальных отделах глубоких вен, более 0,35 секунд — на перфорантных венах [3]. Срок наблюдения за пациентами не органичен.
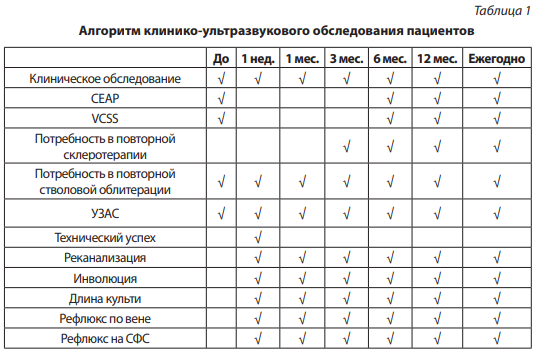
Критериями эффективности являются: технический успех (отсутствие потребности в повторном вмешательстве через 1 неделю); отсутствие реканализации целевой вены (сжимаемость сосуда в В-режиме и (или) наличие кровотока в режиме цветового картирования на протяжении 5 см и более при УЗАС); длина культи БПВ (расстояние от проксимальной границы клеевой облитерации до общей бедренной вены, измеренное по передней стенке БПВ); инволюция вены (отсутствие типичной анатомической структуры в проекции целевой вены в В-режиме при УЗАС); отсутствие рефлюкса по целевой вене (продолжительностью более 0,5 с при проведении дистальной мануальной компрессионной пробы); отсутствие рефлюкса в зоне СФС (длительностью более 0,5 с при проведении пробы Вальсальвы); отсутствие потребности в устранении варикозных притоков в срок свыше 3 месяцев от момента первичного вмешательства; отсутствие потребности в повторном вмешательстве на ранее облитерированной сафенной вене; клинический класс ХЗВ по СЕАР через 6 и 12 месяцев после вмешательства и далее ежегодно; тяжесть ХЗВ по VCSS через 6 и 12 месяцев после вмешательства и далее ежегодно. Алгоритм клинико-ультразвукового обследования представлен в табл. 1.
Критерием безопасности является отсутствие нежелательных реакций, ассоциированных с цианакрилатной облитерацией.
Статистическая обработка данных выполнена в программном пакете IBM SPSS Statistics (v. 19). Все величины приведены в виде средних значений со стандартными отклонениями, медианы с интерквартильным размахом 25–75 перцентиль или относительных величин с 95 % доверительным интервалом (ДИ), рассчитанным по методу Вилсона. Для сравнения относительных величин использован тест хи-квадрат с поправкой на непрерывность. Для сравнения динамики изменения абсолютных величин использовалась общая линейная модель для повторных измерений. Время до наступления событий представлено в виде кривых Каплана — Мейера.
Результаты
С декабря 2017 г. по октябрь 2019 г. было выполнено 122 вмешательства у 92 пациентов с варикозной болезнью: 46 мужчин и 46 женщин в возрасте от 28 до 69 лет (средний возраст 45,3±10,3 лет). Клинический класс ХЗВ соответствовал С2 на 58 конечностях (47,6 %), С3 — на 43 (35,2 %), С4 — на 20 (16,4 %) и С5 на 1 (0,8 %); тяжесть заболевания по шкале VCSS составляла 2–13 баллов (в среднем 6,0±2,1 баллов). Ствол БПВ подвергался облитерации в 100 случаях (82 %), при этом его диаметр, измеренный в области средней трети бедра, колебался в пределах 4,5–18,0 мм (в среднем 9,0±2,5 мм); ствол МПВ — в 22 случаях (18 %), его диаметр, измеренный в области верхней трети голени, составлял 3,7–13,0 мм (в среднем 7,0±2,3 мм). Пункция БПВ осуществлялась в области нижней трети бедра в 23 случаях; верхней трети голени — в 55; средней трети голени — в 4; нижней трети голени — в 18. Таким образом, длина облитерированного участка варьировала в пределах 15–80 см, и составляла в среднем 51,3±13,4 см. Пункция ствола МПВ выполнялась в области средней (n=17, 77 %) или нижней (n=5, 23 %) трети голени, а длина облитерированного участка составляла от 12 до 20 см (в среднем 24,4±5,7 см). Первичная склеротерапия притоков в течение первых 3 месяцев была выполнена на 55 нижних конечностях (45,1 %). Использование компрессионного чулка на протяжении 3 недель было рекомендовано в 21 случае (17,2 %), в течение 6 недель — в 53 случаях (43,4 %).
Технический успех облитерации был достигнут во всех случаях, при этом длина культи БПВ варьировала от 0 до 48 мм (в среднем 19,0±9,7 мм). Период наблюдения за пациентами составлял от 1 недели до 18 месяцев (медиана 3 мес.; интерквартильный размах 1 нед. — 7,5 мес.). При этом через 3 месяца после вмешательства было отслежено 54 % конечностей, через 1 год — 25 % и в срок более одного года — 6 % (табл. 2).
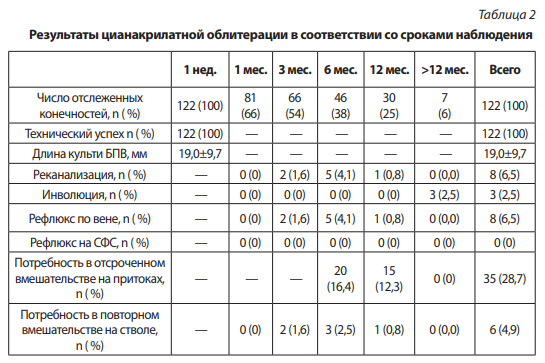
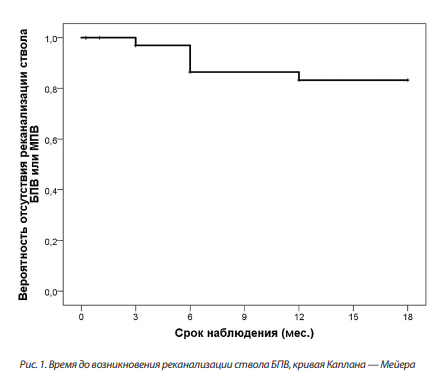
В процессе динамического наблюдения реканализация целевой вены была выявлена в 8 случаях (6,5 %, 95 % ДИ 3,3– 12,3 %) в срок от 3 до 12 месяцев (рис. 1): 6 случаев реканализации ствола БПВ (6,0 %; 95 % ДИ 2,8–12,5 %) и 2 случая реканализации ствола МПВ (9 %, 95 % ДИ 2,5–27,7 %). Восстановление проходимости ствола БПВ сопровождалось наличием клинически значимого рефлюкса, признаков прогрессирования варикозного синдрома (появление новых варикозных вен после склеротерапии или усиление резидуального варикоза), а также усилением вено-специфических жалоб, что являлось показанием к повторному вмешательству на стволе и (или) притоках. Повторное вмешательство было выполнено на 6 нижних конечностях в системе БПВ (4,9 %, 95 % ДИ 2,3–10,3 %) в виде повторной ЦАО (n=1), лазерной облитерации (n=1) и пенной склеротерапии (n=4) с достижением стойкой вторичной окклюзии во всех случаях, кроме одного, где использовалась лазерная облитерация. Данное вмешательство было выполнено на базе другого клинического центра, и его технический успех на момент публикации неизвестен. Реканализация ствола МПВ в 2 случаях не требовала повторного вмешательства на момент анализа данных.
Полную инволюцию наблюдали в 3 случаях (2,5 %; 95 % ДИ 0,9–7,0 %) облитерации БПВ спустя 12 месяцев и более после вмешательства. При этом не удавалось обнаружить типичную структуру венозной стенки или клея в ее просвете. Исходный диаметр инволюционировавших вен составлял 7,0, 8,2 и 9,8, укладываясь в величину одного среднеквадратичного отклонения от среднего значения во всей выборке (6,5–11,5 мм).
Рефлюкс в области СФС не регистрировали ни в одном из 100 случаев облитерированных стволов БПВ (0 %, 95 % ДИ 0,0–3,7 %) на протяжении всего периода наблюдения, несмотря на сохранение достаточно длинной культи.
Рефлюкс по ходу ствола был обнаружен на всех реканализированных венах (6,5 %, 95 % ДИ 3,3–12,3 %) в области средней или нижней трети бедра для БПВ или средней трети голени для МПВ, в местах впадения наиболее крупных притоков.
Потребность в отсроченном вмешательстве на притоках (склеротерапия) возникла на 35 конечностях (28,7 %, 95 % ДИ 21,4–37,3 %) в срок от 6 до 12 месяцев. При этом среди 55 конечностей, на которых склеротерапия была выполнена первично, повторное вмешательство потребовалось в 9 случаях (16,4 %; 95 % ДИ 8,9–28,3 %). Остальные 26 отсроченных вмешательств были выполнены на 67 конечностях с резидуальными варикозными венами (38,8 %, 95 % ДИ 28,0–50,8 %).
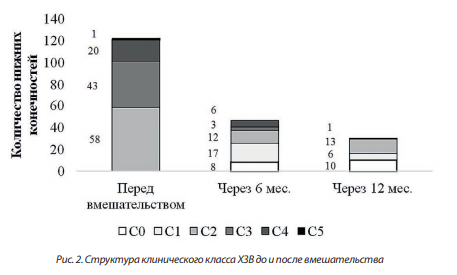
Изменение клинического класса ХЗВ на отслеженных конечностях через 6 и 12 месяцев после вмешательства представлено на рис. 2. Через полгода из 23 отслеженных конечностей с исходным клиническим классом С2 14 (61 %) перешли в классы С0–1 и 9 (39 %) сохранили класс С2; из 15 отслеженных конечностей с исходным классом С3 9 (60 %) перешли в класс С0–1, 3 перешли в класс С2 (20 %) и 3 сохранили класс С3 (20 %); из 8 отслеженных конечностей с исходным классом С4 2 (35 %) перешли в класс С0–1 и 6 (75 %) сохранили класс С4 (p<0,001). Единственная конечность с исходным классом С5 на момент публикации не достигла установленного срока оценки.
Таким образом, регресс клинического класса через 6 месяцев после вмешательства наблюдался на 28 из 46 (61 %) отслеженных конечностях. Через год после вмешательства из 16 отслеженных конечностей с исходным клиническим классом С2 9 (56 %) перешли в классы С0–1 и 7 (44 %) сохранили класс С2; из 8 отслеженных конечностей с исходным клиническим классом С3 4 (50 %) перешли в класс С0–1 и 4 (50 %) перешли в класс С2; из 6 отслеженных конечностей с исходным классом С4 3 (50 %) перешли в класс С1, 2 (33 %) перешли в класс С2 и 1 (17 %) сохранила класс С4 (р = 0,040). Таким образом, регресс клинического класса через 12 месяцев наблюдался на 22 из 30 (73 %) нижних конечностях.
Балл VCSS за период наблюдения уменьшался достоверным образом от 6,0±2,1 до 1,9±1,7 через 6 месяцев и до 1,3±1,2 через 12 месяцев (p < 0,001).
Частота развития нежелательных реакций представлена в табл. 3. Наиболее часто наблюдались воспалительные реакции в проекции облитерированного ствола БПВ (n = 8) и необлитерированных притоков (n = 5). Срок их возникновения варьировал от 1–2 недель до 18 месяцев.
В отдаленном периоде наблюдался единственный случай воспаления ствола БПВ без повышения уровня Д-димера, возникший после курса лечения системными глюкокортикоидами фонового неврологического заболевания. Во всех наблюдениях реакции были купированы применением системных и топических нестероидных противовоспалительных средств, антигистаминных препаратов. Аллергические реакции были представлены крапивницей (n = 2), экзематозными изменениями кожи (n = 1) и аллергическим конъюнктивитом (n = 1), возникновение которых наблюдали в срок от 1–2 недель (кожные проявления) до 18 месяцев (конъюнктивит). Все явления, кроме конъюнктивита, было успешно купированы краткосрочными курсами системных глюкокортикоидов и продленными курсами антигистаминных препаратов.

Ощущение «тяжа» по ходу облитерированной вены было зарегистрировано на 5 конечностях после вмешательства на стволе БПВ. Явления сохранялись в срок от 1 до 6 месяцев с последующим спонтанным и полным исчезновением. Пролабирование клея в область сафено-феморального соустья без распространения на общую бедренную вену наблюдали в двух случаях, которые не требовали специфического лечения и не сопровождались клинически значимыми последствиями в срок наблюдения до 12 месяцев. Пролабирование клея за пределы СФС в общую бедренную вену, занимающее до 25 и 50 % диаметра сосуда в продольном сечении, наблюдалось в двух случаях. Одному пациенту (пролабирование до 50 %) были назначены лечебные дозы антикоагулянтов (ривароксабан 20 мг 1 раз в сутки) на срок до 1 месяца, второму пациенту специфическое лечение не назначалось. При контрольном ультразвуковом исследовании через 1 месяц количество клеевой композиции в просвете бедренной вены не изменилось, но через 12 месяцев в обоих случаях наблюдали полное исчезновение цианакрилата и формирование культи БПВ длиной 8,4 и 9,0 мм соответственно.
За период наблюдения клинических проявлений венозных тромбоэмболических осложнений у названных пациентов не наблюдали. Нарушения чувствительности по типу гиперестезии и парестезии регистрировали на 3 конечностях в срок от 1 недели до 1 месяца после облитерации ствола БПВ на уровне нижней трети бедра — верхней трети голени, они самостоятельно разрешались в течение 12 месяцев. Снижение чувствительности наблюдали в одном случае сразу после облитерации ствола МПВ со спонтанным разрешением симптомов через неделю. Гематома в области сосудистого доступа возникла в одном случае сразу после вмешательства на стволе БПВ, не потребовала дренирования и самостоятельно рассосалась в течение первого месяца наблюдения.
Таким образом, все нежелательные реакции носили несерьезный характер и легко купировались консервативными методами лечения.
Обсуждение
Цианакрилатная облитерация подкожных вен по технологии VenaSeal является эффективным методом устранения стволового рефлюкса, что было продемонстрировано в ранее опубликованных работах. В рамках проспективного когортного исследования eSCOPE 12-месячный рейтинг окклюзии БПВ составлял 93 % [9]; рандомизированное клинические исследование VeClose продемонстрировало, что частота стойкой облитерации БПВ через 36 месяцев может достигать 94,4 % и не отличается от таковой при РЧО по технологии ClosureFast — 91,9 % [10]; в проспективном исследовании WAVES были оценены 12-месячные результаты облитерации не только ствола БПВ, но и МПВ, а также передней добавочной подкожной вены, составившие 100, 100 и 92 % соответственно [12]. Представленная работа является первым крупным когортным исследованием с оценкой результатов цианакрилатной облитерации сафенных вен по технологии VenaSeal на территории России, демонстрирующим сопоставимые с международными исследованиями результаты: частота стойкой окклюзии стволов БПВ и МПВ через 12 месяцев составила 93,5 %. Наблюдаемая длина культи (19,0±9,7 мм) также оказалась сопоставима с зарегистрированной в исследовании VeClose: 22,5 мм после цианакрилатной облитерации и 18,9 мм после РЧО [8].
Помимо хороших технических результатов, преимуществом исследуемого метода является отсутствие строгой необходимости в использовании эластичной компрессии после вмешательства. Такая возможность была ранее продемонстрирована в исследовании eSCOPE [9]. Выполнение ЦАО БПВ без использования компрессионного трикотажа ассоциировалось с высокой вероятностью симптоматического улучшения, а также с отсутствием необходимости в дополнительном вмешательстве на варикозных притоках в 40 % случаев в результате их спонтанной регрессии.
В рамках выполненного исследования компрессионная терапия не использовалась на 48 конечностях (39,4 %), операция заканчивалась наложением давящей повязки в месте сосудистого доступа. В остальных случаях потребность в эластичной компрессии определялась проведением сочетанной склеротерапии или наличием выраженных веноспецифических симптомов.
Самостоятельный регресс варикозных притоков на протяжении первых 3 месяцев наблюдения даже при отсутствии эластичной компрессии был продемонстрирован в исследовании WAVES [12]. Перед вмешательством потребность в выполнении минифлебэктомии оценивалась на уровне 74 %, а склеротерапии — на уровне 90 %. При этом реальная частота выполнения вмешательств на варикозных притоках через 3 месяца составила 14 и 66 % соответственно. В рамках проведенного исследования выполнение первичной (в течение первых 3 месяцев) и повторной (спустя 3 месяца) склеротерапии требовалось на 81 (66 %) нижней конечности, что соответствует ранее опубликованным результатам.
Купирование клинических симптомов и признаков ХЗВ, отраженное в достоверном уменьшении баллов VCSS и регрессе клинического класса по СЕАР, соответствует аналогичным результатам исследования VeClose, согласно которым клиническое улучшение после ЦАО достоверно не отличается от такового при РЧО [10].
Что касается нежелательных реакций, то частота их регистрации в рамках проведенной работы также не отличается от опубликованных ранее данных [8, 9]. Наиболее распространенными являются воспалительные изменения в проекции облитерированных вен, частота возникновения которых может достигать 10–20 %. Причина названных изменений в последнее время переосмысливается, и все большая роль отдается реакциям гиперчувствительности замедленного типа, которые могут обусловливать до 6 % всех воспалительных изменений с развитием тяжелых реакций, требующих хирургического удаления вены, в 0,3 % [13]. В связи с этим цианакрилатная облитерация не рекомендуется лицам, страдающим псориазом, атопическим дерматитом, имеющим анамнестические указания на аллергические реакции в отношении кожных адгезивов (клей для наращивания ногтей, ресниц, лейкопластыри и пр.). Также отдельным пациентам рекомендуется выполнять накожную аллергическую пробу с цианакрилатом.
Среди нежелательных реакций отдельный интерес представляет пролабирование клея в общую бедренную вену, частота регистрации которого достигала 1,6 %. В литературе имеются сведения о том, что частота регистрации названных явления может достигать 13 % [14]. Как бы то ни было, согласно имеющимся данным, адгезив в бедренной вене полностью рассасывается на протяжении 8 недель — 12 месяцев без развития симптоматических форм венозных тромбоэмболических осложнений.
Таким образом, проведенное исследование подтверждает ранее опубликованные данные о том, что цианакрилатная облитерация сафенных вен по технологии VenaSeal является эффективным и безопасным методом устранения стволового рефлюкса у пациентов с варикозной болезнью. Между тем, наличие специфических осложнений, связанных с имплантацией и длительным нахождением инородного тела в организме, требует аккуратного отбора пациентов, критерии которого могут быть уточнены при проведении дальнейших исследований и накоплении клинического материала.


