Эрозивно-язвенные поражения желудка и двенадцатиперстной кишки остаются важной социально-экономической проблемой, так в России примерно 5–15% населения имеют эрозии или язвы желудка и 12-перстной кишки. Эрозивно-язвенные поражения гастродуоденальной слизистой являются основной причиной кровотечений из верхних отделов желудочно-кишечного тракта: язвы лежат в основе 46–56% кровотечений, эрозии желудка и двенадцатиперстной кишки — в основе 16–20% кровотечений [1] (рис. 1).

Рисунок 1. Язва желудка, желудочно-кишечное кровотечение
Ежедневно в мире 30 млн человек принимают НПВП, которые оказывают многостороннее повреждающее действие на слизистую оболочку ЖКТ. Факторы риска развития НПВП-гастропатии: возраст > 65–70 лет; анамнез язвенной болезни и желудочно-кишечного кровотечения; первые три месяца приема НПВП; курение; фоновые ССЗ или заболевания органов дыхания; одновременная терапия стероидами или антикоагулянтами; прием НПВП в больших дозах или более двух препаратов одновременно; контаминация гастродуоденальной слизистой оболочки активными штаммами Helicobacter pylori [2,3].
По данным западных авторов, в общей популяции язвы желудка или ДПК выявляются у 10–15% пациентов, регулярно принимающих НПВП, а желудочно-кишечное кровотечение или перфорация в течение года может развиться в 1–1,5% случаев [4].
По данным американских исследователей, осложнения гастропатий индуцированных НПВП — желудочно-кишечных кровотечений и перфораций язв, составляют около 70 000 случаев в год, причем примерно каждый десятый с развившимся подобным осложнением погибает. Однако, у больных ИБС общий риск желудочно-кишечного кровотечения в 2–3 раза увеличивает перманентный прием ацетилсалициловой кислоты (АСК) с целью вторичной профилактики обострений ИБС [5].
Риск эрозивно-язвенных поражений слизистой желудочно-кишечного тракта почти в 10 раз увеличивает сочетанное применение НПВП и глюкокортикостероидов (ГКС). Этот феномен можно объяснить конаправленным действием НПВП и ГКС на тканевые простагландины класса Е: оба класса препаратов неселективно блокируют фермент фосфолипазу А2 в цикле арахидоновой кислоты и в рамках системного противовоспалительного действия приводят к уменьшению образования простагландинов. Риск эрозивно-язвенных поражений на фоне приема НПВП также значительно выше у пациентов, принимающих лекарственные препараты из группы ингибиторов обратного захвата серотонина (антидепрессанты) и блокаторы кальциевых каналов (гипотензивные и спазмолитики).
Одновременный длительный прием селективных НПВП и низких доз АСК, назначаемых для профилактики обострений ИБС, несмотря на предполагаемую большую безопасность селективных НПВП, также существенно повышает риск осложненных поражений верхних отделов ЖКТ. Так, в исследовании CLASS было показано, что частота желудочно-кишечного кровотечения и перфорации язв у больных, принимавших целекоксиб одновременно с АСК, практически не различалась от таковой у получавших ибупрофен и диклофенак, и составляла 2,01% и 2,12% соответственно [6].
КЛИНИЧЕСКИЙ ПРИМЕР
Пациентка Д., 90 лет
Повод для госпитализации по СМП: подозрение на желудочно-кишечное кровотечение.
Жалобы: потеря сознания, черный стул
Анамнез заболевания: ухудшение состояния в день госпитализации, когда возникли жалобы на черный стул, потерю сознания, в связи с чем госпитализирована по СМП. Длительно болевой синдром в связи с полиостеоартрозом, асептическим некрозом головки правой бедренной кости с 2011 г, по поводу чего постоянно принимает НПВП.
Анамнез жизни: гипертоническая болезнь с максимальными цифрами АД 200/100 мм рт.ст., привычные цифры АД 130/90 мм рт.ст., принимает эналаприл 5 мг 2 раза в сутки. Аллергоанамнез не отягощен.
При осмотре: состояние средней тяжести. В сознании. Кожные покровы обычной окраски. Периферические л\у не увеличены. ЧДД 18 в мин. Дыхание в легких везикулярное, хрипов нет. ЧСС 68 в мин. АД 130/90 мм рт.ст. Тоны сердца приглушены, ритм правильный, шумов нет. Живот мягкий, болезненный в области эпигастрия. Печень, селезенка не увеличены.
Тактика: госпитализирована в отделение хирургии, где поставлен диагноз:
Язва 12-перстной кишки хроническая. Состоявшееся желудочно-кишечное кровотечение.
Выполнены общий анализ крови: гемоглобин 110 г\л (MCV 78), СОЭ 12 мм\л, ЭГДС: множественные эрозии слизистой желудка и 12 перстной кишки, состоявшееся ЖКК (рис. 2, 3).
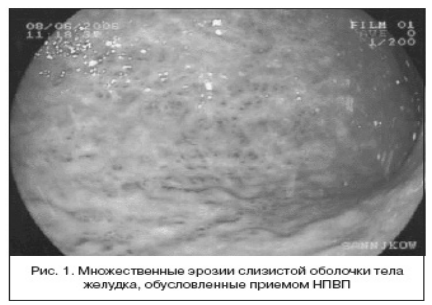
Рисунок 2. Эрозии желудка
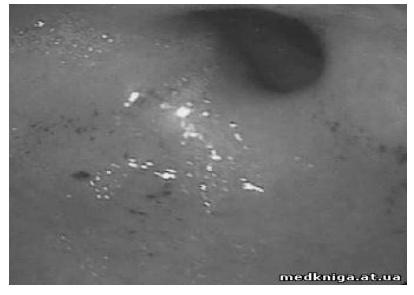
Рисунок 3. Эрозии 12-перстной кишки
Консультация терапевта в отделении хирургии, поставлен диагноз:
Основной: НПВП-гастропатия. Фон: Асептический некроз головки правой бедренной кости. Осл: Состоявшееся ЖКК. Соп: Хроническая ишемия головного мозга. Гипертоническая болезнь 2 ст, ст АГ 3, высокого риска.
После исключения острой хирургической патологии рекомендован перевод в отделение терапии.
Проводимое лечение: Т. Ребамипид 100 мг 1 таб 3 раза в сутки, К. Омепразол 40 мг в сутки; Т. Лозартан 25 мг 1 раз в сутки; Мидокалм 1.0 в/м 1 раз в сутки
ЭГДС-контроль через 14 дней: Хронический гастродуоденит.
Патогенез ЭЯП слизистой оболочки желудка и ДПК универсален и практически полностью определяется степенью нарушения артериального кровообращения в стенке желудка. В настоящее время известно, что ЭЯП у больных развивается в результате кислотного повреждения слизистой оболочки на фоне острой или хронической ишемии гастродуоденальной слизистой оболочки, приводящей к угнетению всех механизмов гастропротекции: секреции бикарбоната, муцина, пролиферации эпителия [7]. Однако у части больных, особенно у длительно иммобилизованных, развитию ЭЯП могут способствовать и другие факторы агрессии, такие как дуоденогастральный желчный рефлюкс и гастропарез [8]. Детальный патогенез развития язвенно-эрозивного поражения гастродуоденальной слизистой оболочки ЖКТ вследствие приема НПВП до конца не изучен, однако доказано, что его основным механизмом является необратимое блокирование синтеза тканевых простагландинов класса Е. Дефицит простагландинов класса Е в слизистой оболочке желудка приводит, как и при ишемии гастродуоденальной слизистой, к уменьшению секреции всех факторов гастропротекции: снижению синтеза муцина и бикарбоната, уменьшению регенерации желудочного и дуоденального эпителия. Этот механизм действия НПВП является наиболее значимым и определяет как их терапевтический эффект (анальгезия, антипирексия, подавление воспалительной реакции), так и побочные эффекты (гастроинтестинальная токсичность и нарушение почечного кровотока). Кроме того, НПВП обладают способностью в кислой желудочной среде непосредственно проникать в клетки слизистой оболочки, нарушая слизисто-бикарбонатный барьер и вызывая обратную диффузию ионов водорода, и оказывать таким образом прямое, “контактное” повреждающее действие на клетки покровного эпителия. В этом плане особую опасность представляют так называемые кислые НПВП, которые не ионизируются в желудке (АСК и производные пропионовой кислоты — ибупрофен, напроксен и кетопрофен). Одним из основных моментов в патогенезе контактного действия НПВП может являться блокирование ферментных систем митохондрий эпителиоцитов, вызывающее нарушение процессов окислительного фосфорилирования и приводящее к развитию каскада некробиотических процессов в клетках. Это проявляется снижением устойчивости клеток слизистой оболочки к повреждающему действию кислоты и пепсина и уменьшению их регенераторного потенциала. Хотя НПВП могут вызывать специфические изменения гастродуденальной слизистой оболочки, соответствующие гистологической картине «химического» гастрита, в большинстве случаев эта патология маскируется проявлениями гастрита, ассоциированного с H. pylori [9].
В отличие от H. pylori — ассоциированной язвенной болезни, при которой характерным фоном язвы является хронический активный гастрит — при НПВП–гастропатии язвы могут выявляться при минимальных воспалительных изменениях гастродуоденальной слизистой оболочки [5].
Особое клиническое значение имеет проблема увеличения риска ЭЯП и желудочно-кишечных кровотечений у больных с ИБС, длительно получающих АСК. Установлено, что АСК в низких дозах, как и другие НПВП, способна раздражать слизистую оболочку желудка и приводить к ее повреждению с образованием эрозий и язв, а также к желудочно-кишечным кровотечениям [10].
Так, в Великобритании число кровотечений у больных ИБС, принимающих профилактические дозы аспирина, составляет около 3500 случаев в год. Роль H. pylori в развитии эрозивно-язвенных поражений слизистой оболочки желудка и двенадцатиперстной кишки у больных с ИБС.
Нередко пациенты предъявляют диспепсические жалобы, не имеющие прогностического значения в отношении развития НПВП-ассоциированного поражения пищеварительного тракта и это приводит к тому, что частота рецидивов НПВП-индуцированных язв и множественных эрозий у больных в контрольных группах исследований SCUR, ASTRONAUT, OMNIUM значительно варьирует и, по данным метаанализа, в течение 3–6 месяцев наблюдений составляет от 16% до 49% [11]. Между тем, ряд исследователей придерживается мнения, что феномен так называемых немых язв зачастую отражает не полное отсутствие специфических симптомов ЭЯП, но их умеренную выраженность или приоритетность симптомов основного заболевания [12].
Таким образом, даже полное отсутствие жалоб не позволяет исключать наличие тяжелого гастродуоденального поражения и, по сути, медицинская помощь при ЭЯП у больных ИБС, как и при НПВП-гастропатии, базируется на его профилактике — выявлении «факторов риска» поражения ЖКТ.
Организация своевременной профилактической антисекреторной терапии у больных с высокой концентрацией факторов риска НПВП-гастропатии (более 2) приводит к существенному уменьшению частоты поражения ЖКТ, поскольку само по себе прекращение приема НПВП у большинства больных не приводит к заживлению ЭЯП. Косвенные данные по этому вопросу дает оценка эффективности плацебо в исследовании Tildesley G.: за 4 недели заживление язв желудка и ДПК отмечалось менее чем у половины больных, которым были отменены НПВП.
«Золотым стандартом» современной антисекреторной терапии является назначение ингибиторов протонной помпы (ИПП). ИПП сегодня являются самыми мощными антисекреторными препаратами и при этом являются безопасными и удобными в применении [13]. Вместе с тем проблема эрозивно-язвенных поражений ЖКТ не решена полностью. По-прежнему представляет сложности лечение пациентов с НПВП–гастропатиями, энтеро- и колопатиями, Нр-негативной язвенной болезнью, симптоматическими язвами и эрозиями. При этом известно, что негативное действие НПВП на ЖКТ не ограничивается желудком и двенадцатиперстной кишкой, а антисекреторные препараты не действуют вне данных органов [14]. В России появился новый препарат Ребамипид. Основной механизм действия ребамипида заключается в стимулировании синтеза простагландинов, прежде всего Е2 и GI2, факторов роста, повышении продукции желудочной слизи и гликопротеинов, ингибировании продуктов оксидативного стресса, воспалительных цитокинов и хемокинов в слизистой оболочке ЖКТ. Доказано влияние ребамипида на циклооксигеназу-2 посредством временной активации генов, кодирующих ее, на активацию энзимов, ускоряющих биосинтез высокомолекулярных гликопротеинов, на повышение содержания слизи на поверхности стенки желудка. Ребамипид способствует улучшению кровоснабжения слизистой оболочки ЖКТ и ее барьерной функции, повышает пролиферативно-метаболический потенциал эпителиальных клеток желудка, освобождает слизистую от гидроксильных радикалов и подавляет супероксиды, продуцируемые полиморфно-ядерными лейкоцитами и нейтрофилами в присутствии Helicobacter pylori, оказывает противовоспалительное и протекторное действие при воздействии на слизистую ЖКТ этанола, кислот, щелочей, ацетилсалициловой кислоты и НПВП [15]. При аспирин-индуцированных поражениях тонкой кишки в эксперименте использование ребамипида способствует улучшению состояния кишечной стенки за счет стимулирования пролиферации эпителиоцитов и регенерации эпителиальных повреждений тонкой кишки путем регулирования экспрессии ЦОГ-2 и накопления β-катенина [16]. Предполагается также, что ребамипид может быть использован в качестве профилактики НПВП-гастропатии и энтеропатии путем модуляции микробиоты и подавления воспаления слизистой оболочки в тонкой кишке за счет снижения активности экспрессии генов ФНО-a и двойной оксидазы-2 [17]. На данный момент накоплена обширная доказательная база по клинической эффективности ребамипида. Данные 10-летнего метаанализа по изучению клинической эффективности ребамипида при НПВП-индуцированных поражениях слизистой оболочки желудка и тонкой кишки, опубликованные S. Zhang и соавт. в 2013 году [18], свидетельствуют о достоверно более высокой эффективности ребамипида по сравнению с плацебо. В рандомизированном, двойном слепом, плацебо-контролируемом исследовании К. Tozawa и соавт. (2014) на здоровых добровольцах была установлена эффективность ребамипида при вызванных аспирином и клопидогрелем повреждениях слизистой оболочки желудка [19]. Использование видеокапсульной эндоскопии позволило установить протективный эффект ребамипида при эрозивно-язвенных, в том числе НПВП-индуцированных поражениях слизистой оболочки не только для гастродуоденальной зоны, но и для всей тонкой кишки [20–22]. В значительном количестве исследований, проведенных в Японии и Корее, продемонстрирована достоверно более высокая эффективность четырех- и восьминедельных схем комбинированной терапии «ИПП + ребамипид» по сравнению с монотерапией ИПП для заживления больших ятрогенных язв после эндоскопической подслизистой диссекции по поводу аденомы желудка или раннего рака желудка [23–25].
Таким образом, ныне собрана значительная экспериментально-клиническая база данных, свидетельствующая об эффективности ребамипида как гастро- и энтеропротективного лекарственного средства для лечения и профилактики эрозивно-язвенных повреждений желудка и тонкой кишки, включая аспирин- и НПВП-индуцированные, улучшающего защитные свойства слизистой оболочки ЖКТ и не имеющего аналогов с подобным сочетанием лечебных эффектов.
Статья получена 22.01.2016


