АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
По прошествии более полувека с момента открытия возбудителя вопросы борьбы с вирусным гепатитом В (ГВ) остаются актуальными. В России вакцинация против этой инфекции, введенная в 1996 г., стала основным средством успешной профилактики и значительного снижения заболеваемости населения.
Однако в ходе реализации программы массовой вакцинопрофилактики ГВ в рамках приоритетного национального проекта «Здоровье», начатого в нашей стране в 2006 г., был выявлен ряд вопросов, касающихся новых особенностей изменившейся эпидемиологии этой инфекции. Основным из них стал поиск адекватной для каждого региона страны стратегии вакцинации населения. Было показано, что эффективность иммунобиологических препаратов варьирует в зависимости от генотипа вируса гепатита В (ВГВ), используемого для их конструирования.
Накопление эпидемиологических и клинических данных о современных особенностях распространения этой инфекции стало основой совершенствования мер профилактики и системы государственного санитарно-эпидемиологического надзора в целом и позволило Всемирной организации здравоохранения поставить цель по элиминации возбудителя ГВ к 2030 г.
Несмотря на значительные успехи профилактики, ГВ является глобальной проблемой мирового и отечественного здравоохранения в связи с широкой распространенностью, полиморфизмом клинических проявлений и возможностью формирования хронической формы заболевания с развитием цирроза печени и гепатоцеллюлярной карциномы (ГЦК). По данным Всемирной организации здравоохранения (ВОЗ), в 2019 г. в мире насчитывалось 296 млн человек, живущих с хроническим гепатитом В (ХГВ), и 820 тыс. случаев летальных исходов [1].
Цель работы — систематизировать и обобщить данные научной литературы о современных особенностях эпидемиологии гепатита В в России.
МАТЕРИАЛЫ И МЕТОДЫ
Для достижения поставленной цели выполнен поиск литературных источников с использованием электронных библиографических ресурсов https://pubmed.ncbi.nlm.nih.gov/ и https://elibrary.ru/ по ключевым словам «гепатит В», «вакцинопрофилактика». Всего процитировано 32 отечественных и 13 зарубежных источников.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В Российской Федерации начиная с нового столетия отмечается постепенное снижение уровня заболеваемости острым гепатитом В (ОГВ) [2]. По данным государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2020 году», показатель заболеваемости в 2020 г. по сравнению с 2011 г. уменьшился на 79,5 %, составив соответственно 0,35 и 1,71 на 100 тыс. населения1. Достижение таких значительных успехов в борьбе с данной инфекцией стало возможным благодаря реализации программы массовой иммунизации населения Российской Федерации против ГВ. В то же время продолжает сохраняться активность эпидемического процесса ХГВ с тенденцией к снижению: 4,36 на 100 тыс. населения в 2020 г. Динамика заболеваемости ОГВ и ХГВ с 2011 по 2020 г. представлена на рисунке.
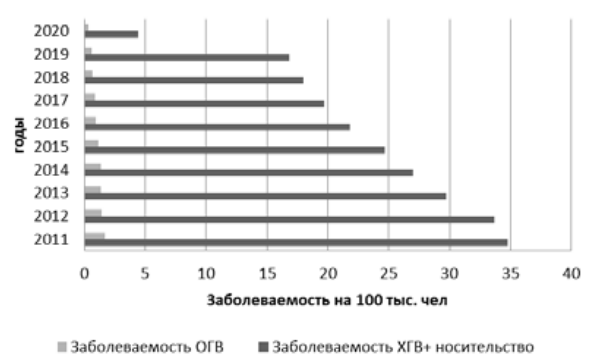
Рисунок. Динамика заболеваемости ОГВ и частота регистрации хронической инфекции, вызванной ВГВ (ХГВ и носительство (до 2019 г.) ВГВ), на 100 тыс. населения с 2011 по 2020 г. Fig. The dynamics of the incidence of HBV and the frequency of registration of chronic infection caused by HBV (HCV and carrier (until 2019) of HBV), per 100 thousand population from 2011 to 2020.
Несколько иные данные получены в Москве, где показатель заболеваемости ОГВ в 2020 г. составил 1,36 на 100 тыс. населения (в 2019 г. — 1,52 на 100 тыс. населения), превысив среднероссийские значения в 3,9 раза, (показатель заболеваемости в РФ ОГВ составил 0,35 на 100 тыс. населения). Заболеваемость ХГВ в 2020 г. также превышала показатели по Российской Федерации и была в 2,1 раза выше (9,15 и 4,36 на 100 тыс. населения соответственно). По мнению специалистов, причиной сохраняющихся высоких уровней заболеваемости ХГВ явилось выраженное эпидемиологическое неблагополучие по заболеваемости ОВГ, имевшее место в РФ в конце прошлого — начале текущего столетий.
Динамика уровней заболеваемости ОВГ и ХВГ в последние годы во многом связана с существенным изменением структуры путей передачи ВГВ. С начала 1990-х гг. значительно уменьшилась частота заражения ВГВ в медицинских учреждениях при проведении инвазивных манипуляций. Среди больных ОГВ резко сократилась доля лиц, заражение которых связано с переливанием крови и/или ее препаратов, однако активизировался половой путь передачи возбудителя и инъекционное введение наркотических препаратов [3–5]. Среди населения РФ в 2017 г. в структуре установленных причин инфицирования ВГВ наибольшую долю составила передача вируса половым путем — 30,0 %, при парентеральном введении психотропных препаратов — 10,4 %, при проведении медицинских манипуляций — 4,6 %, косметические процедуры, включающие пирсинг, татуировки, маникюр, педикюр и другие, — 3,8 %, остальные (включая вертикальный) — 4,1 %. Однако в наибольшем числе случаев источник инфицирования остается неустановленным (47,1 %), что требует безотлагательных мер по повышению качества методов лабораторной и эпидемиологической диагностики [6].
Эволюция эпидемиологической ситуации неизбежно привела к изменению возрастной структуры больных ОГВ в большинстве регионов России, и в настоящее время она имеет определенные особенности и значительно отличается от той, что имела место в предыдущие годы. Возрастная группа 15–19 лет, за счет которой происходил основной прирост случаев в конце прошлого века, сместилась группой 20–29 лет к 2008 г. и 30–39 лет — в 2016–2017 гг. В настоящий момент можно сделать вывод о том, что ОВГ «повзрослел», а именно 97,4 % новых случаев приходятся на возраст старше 20 лет [6]. Подобная тенденция отмечается практически во всех федеральных округах России. Так, например, в Москве в 2020 г. наблюдалось перераспределение заболеваемости ОГВ в группах взрослого населения, однако наибольший удельный вес заболевших по-прежнему приходился на возрастную группу 30–39 лет. Как следует из материалов государственного доклада «О состоянии санитарно-эпидемиологического благополучия населения в городе Москве в 2020 году», доля заболевших ОГВ в группе 18–29 лет в 2020 г. возросла в 1,7 раза по сравнению с 2019 г. За долгий период времени удалось добиться снижения детской заболеваемости ОГВ. На сегодняшний день у детей вне зависимости от возраста показатель заболеваемости стремится к минимальным значениям.
Вакцинация, признанная основным средством профилактики ГВ, бесспорно, внесла значительный вклад в этот процесс [7]. В России иммунизация новорожденных против гепатита В была включена в Национальный календарь профилактических прививок в 1996 г., подростков — в 2001 г. и взрослых — в 2016 г. По данным Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека в 2020 г., в Российской Федерации вакцинировано против гепатита В 2,15 млн человек, в том числе 1,45 млн детей, при этом своевременный охват прививками детей в возрасте 12 мес. в 2020 г. составил 96,72 % (в 2019 г. — 97,06 %).
Несмотря на наличие официальной статистической отчетности, отражающей охват и своевременность иммунизации, эта информация не всегда соотносится с фактической защищенностью различных групп населения от той или иной инфекции. В связи с этим чрезвычайно важным является проведение лабораторных исследований, позволяющих оценить состояние иммунитета населения. Высокая иммунологическая эффективность вакцинации против ГВ на основании данных серологического мониторинга состояния популяционного иммунитета в различных регионах России подтверждена результатами многочисленных исследований [8–12]. Мониторинг эффективности вакцинации осуществляется преимущественно путем оценки гуморального иммунного ответа, т. е. уровня титров антител, поскольку определение антиген-специфичного Т-клеточного ответа, который также играет важную роль в защите от ГВ, является дорогостоящим и трудоемким методом и не используется в рутинной практике здравоохранения [13]. Несмотря на то что достоверность использования серологических методов в отношении ГВ зависит от целого ряда факторов (является ли маркер результатом перенесенной инфекции или прививки, различная чувствительность или специфичность тест-систем и др.) [14, 15], сероэпидемиологические популяционные исследования являются мощным инструментом для прогнозирования и контроля эффективности программ специфической профилактики [16–18]. Дальнейшая иммунизация детей и взрослых против ГВ в рамках Национального календаря профилактических прививок, наряду с совершенствованием подходов к оценке эффективности вакцинации, может приблизить к достижению целевых показателей глобальной стратегии ВОЗ по борьбе с гепатитом, одобренной всеми государствами — членами организации: сократить число новых случаев инфицирования на 90 % и смертность на 65 % в период с 2016 по 2030 г. [5].
В настоящее время в России зарегистрированы различные отечественные и зарубежные генноинженерные вакцины против ГВ, произведенные на основе технологии рекомбинантной ДНК. Все они содержат поверхностный антиген ВГВ (HBsAg), продуцируемый дрожжевыми клетками после включения в геном этих клеток гена, экспрессирующего HBsAg, что обеспечивает близость их химических и иммунологических характеристик. Препараты вводятся по стандартной схеме 0–1–6 месяцев, однако по показаниям возможно применение альтернативных вариантов схем (экстренной, интенсивной и др.) [19, 20].
При этом существует ряд проблем, требующих коллегиального научного решения. Например, отдельного внимания заслуживает вопрос несоответствия серотипа (субтипа) HВsAg вакцинных препаратов и штаммов ВГВ, циркулирующих на той или иной территории. Установлено наличие как минимум 10 субтипов ВГВ, входящих в два серотипа — ay и серотип ad, циркуляция которых имеет территориальные закономерности.
В исследовании, проведенном в Западной Сибири, была выявлена циркуляция трех генотипов ВГВ (A, С и D) с доминированием во всех регионах генотипа D. Изучение генетической гетерогенности HBsAg позволило установить преобладание серотипа ay среди условно здорового населения: ayw2 (57 %), ayw3 (42 %) и adw2 (1 %) [21]. Эти данные были подтверждены при обследовании пациентов многопрофильного стационара в Москве, где в 83,3 % изолятах ВГВ определялся генотип D, серотип ay (ayw3 и ayw2) [22]. В масштабном исследовании образцов сывороток крови больных ОГВ и ХГВ обнаружено преобладание во всех исследуемых 36 субъектов Российской Федерации генотипа D, распространенность которого в целом по стране составила 85 %. Генотипы А и С встречались значимо реже — в 10,7 и 3,2 % случаев. Штаммы ВГВ генотипа D, циркулирующие в России, относились к серотипам ayw2 и ayw3, штаммы генотипа А — к серотипу adw2, а штаммы генотипа С — к серотипу adr [23]. Учитывая преобладание в Российской Федерации серотипа ay, целесообразно использование вакцин, включающих HBsAg данного серотипа. При использовании вакцин, не соответствующих циркулирующему серотипу, имеет место рост числа случаев заболевания ОГВ среди вакцинированных лиц [24].
Этим требованиям соответствует отечественная рекомбинантная дрожжевая вакцина против ГВ, разработанная НПК «Комбиотех» в 1992 г. Данная вакцина содержит HBsAg разных серотипов (ау и ad) и обеспечивает максимальную защиту против ВГВ, циркулирующего на территории Российской Федерации. Вакцина по своим характеристикам полностью отвечает требованиям ВОЗ и по соответствию серотипов HBs антигена является приоритетной для защиты населения нашей страны. Кроме того, она обладает высокой иммунологической активностью и обеспечивает высокий уровень серопротекции среди различных групп населения, в том числе групп риска инфицирования ВГВ [11, 12, 25–27].
Наряду с проблемой несоответствия серотипов, причиной возникновения ГВ у лиц, прошедших полный курс вакцинации, может быть инфицирование штаммами ВГВ с наличием мутаций в области генома, ускользающих от протективного действия иммунной системы [28, 29]. Проблема мутантных форм ВГВ в последнее время становится все более актуальной, поскольку массовая вакцинация населения против ГВ и применение противовирусных препаратов для лечения ХГВ способствуют их селекции и распространению [30]. На данный момент в мире пока не существует зарегистрированной вакцины против основного эскейп мутанта G145R ВГB. В то же время разработка рекомбинантных вакцин нового поколения, обеспечивающих индукцию протективного иммунитета как против дикого типа, так и против HBsAg-мутантных вариантов ВГВ, является чрезвычайно актуальной и необходимой для предупреждения их распространения. Исследования в этом направлении уже проводятся в России, и успешное завершение III фазы клинического исследования новой трехвалентной вакцины гепатита B рекомбинантной дрожжевой — Бубо®-Унигеп (содержит антигены HBsAg серотипов ay и ad и детерминанту с мутацией G145R) планируется весной 2022 г. [31, 32].
Убедительные данные о выраженной профилактической эффективности вакцин против ГВ у иммунокомпетентных лиц ставят на повестку дня вопрос об адекватности реагирования на вакцину отдельных категорий населения с иммунодефицитными состояниями, включая пациентов с хроническими заболеваниями печени и почек, аутоиммунной патологией, ВИЧ-инфицированных и др., а также лиц с микст-инфекциями, вызванными гепатотропными вирусами [33–36]. Обобщив данные многочисленных исследований, рядом авторов было установлено, что около 10 % населения не отвечает на введение вакцины против ГВ по стандартной схеме (0, 1, 6 месяцев) выработкой антител к HBsAg на защитном уровне (> 10мМЕ/мл). Причем показатель частоты неэффективности проведенной вакцинации связан с наличием коморбидной патологии, ожирения, наличия вредных привычек и ряда других причин, приводящих к иммуносупрессии. Кроме того, не исключается значимость иммуногенетических особенностей макроорганизма, поскольку система главного комплекса гистосовместимости играет одну из ведущих ролей в генетическом контроле иммунного ответа в норме и при патологии [13, 37, 38].
Особую категорию лиц с наличием физиологического иммунодефицита вследствие инволюции тимуса составляют люди пожилого возраста. Ослабление функционирования гуморального и клеточного звена иммунитета, снижение продукции цитокинов, нарушение функции моноцитарной системы в старческом возрасте, в свою очередь, приводит к нарушению адекватного реагирования на вакцинацию [13, 39]. Так, в открытом проспективном исследовании оценивали длительность иммунитета к ГВ у пожилых людей спустя 30 месяцев после вакцинации. Показано, что лишь 70 % вакцинированных были серопозитивными. При мультивариантном анализе результатов этого исследования возраст оказался независимым фактором, позволяющим прогнозировать уровень ответа на вакцинацию [40].
Общие рекомендации в отношении лиц с иммунодефицитными состояниями сводятся к тому, что они должны быть привиты против ГВ в связи с повышенным риском инфицирования и вероятностью развития тяжелых форм заболевания. По мнению специалистов, стратегия вакцинации данной категории лиц не должна носить эмпирический характер, а следует предусматривать предвакцинальный скрининг на наличие маркеров ВГВ (HBsAg, анти-HBc и антиHBs). Для лиц, имеющих изолированные анти-HBc без HBsAg или анти-HBs, должны рассматриваться такие возможные варианты, как ложнопозитивное выявление анти-HBc, иммунитет к ГВ при отсутствии детектируемых анти-HBs или, в небольшом проценте случаев, наличие оккультной (скрытой) ГВ-инфекции [13, 29]. В таких случаях рекомендуют проводить иммунизацию по стандартной схеме и провести поствакцинальный скрининг для количественного определения титров антител и выявления лиц, слабо ответивших на иммунизацию, или нон-респондеров. При достижении протективного уровня анти-HBs > 10 мМЕ/мл введение дополнительных (бустерных) доз считается нецелесообразным [39, 41].
Поскольку причины слабого ответа (или его отсутствия) на рекомбинантную вакцину против ГВ являются многофакторной проблемой, возможно использование нескольких подходов для ее решения. К ним относятся изменения схемы вакцинации, включая увеличение дозы и кратности введения вакцин; применение различных адъювантов, различающихся по происхождению и механизму действия; коррекция функций иммунной системы для восстановления адекватного реагирования на вакцинные препараты, а также создание комбинированных вакцин, включающих различные серотипы HBsAg диких штаммов и эскейп-мутанты [42–44].
Таким образом, проблема вирусного гепатита В не является полностью решенной. По мнению специалистов, приоритетными направлениями являются снижение уровня заболеваемости, поддержание высокого уровня иммунизации, модернизация клинико-лабораторных возможностей для массового обследования населения, разработка новых препаратов и схем вакцинации [6].
ЗАКЛЮЧЕНИЕ
Дальнейшая иммунизация детей и взрослых против ГВ в рамках Национального календаря профилактических прививок, наряду с изучением вопросов, связанных с проблемой иммунологической памяти, а также совершенствованием подходов к вакцинации лиц с иммунодефицитными состояниями и оценке ее эффективности, может приблизить к достижению целевых показателей глобальной стратегии ВОЗ по борьбе с гепатитом, одобренной всеми государствами — членами организации.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Финансирование. Исследование не имело спонсорской поддержки.
Вклад авторов: все авторы внесли существенный вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию до публикации.
Conflict of interest. The authors declare that there is no conflict of interest.
Funding. The study had no sponsorship.
Authors ‘contribution: all authors made a significant contribution to the search and analytical work and the preparation of the article, read and approved the final version before publication.


