ВВЕДЕНИЕ
Вирусы — уникальные частицы переходной формы от неживого и живому. Строение вирусных агентов копирует металлические решетки сложных химических элементов [6]. Паразитология рассматривает вирусы как внутриклеточные паразиты, влияющие на генетический аппарат. Биохимические науки оценивают вирусы как некие генетические мобели, обладающие выраженной мобильностью. Открытие генетических особенностей в 1969 г. принадлежит М.Дельбрюку, А. Херши и С. Лурия (Max Delbruck, Alfred D. Hershey, Salvador E. Luria). Этим ученым была присуждена Нобелевская премия в области физиологии и медицины. Несмотря на то что с латинского virus, переводится как «яд», нужно отдать должное этим сущностям как основным двигателям и катализаторам эволюцию. Именно вирусам, обладающим безграничной мутационной активностью, принадлежит способность изменять все живое [1]. Элементарной классификацией вирусов считается их разделение на ДНК- и РНКсодержащие (по http://www.expasy.org/ viralzone).
Цель обзора. В статье приводятся обзорные данные о сезонных, респираторных, РНК-содержащих вирусах. Наибольшее внимание уделяется вирусам семейства коронавируса (КВ). Основой адаптационных возможностей вирусов является огромное генетическое разнообразие, которое характеризует популяции РНК-вирусов.
Основными характеристиками РНКсодержащих вирусов являются следующие особенности [8, 9]: РНК-вирусы имеют самую высокую мутационную активность, превышающую таковую у представителей ДНК-содержащих вирусов в несколько раз. Несмотря на то что большинство мутаций для самого вируса бывает летальными, в процессе мутации сохраняется достаточное количество вирусных агентов, наделенных новыми патогенными свойствами; с эволюционной точки зрения именно мутации позволяют вирусам, особенно РНК-содержащим, определять некий выбор мутационной устойчивости.
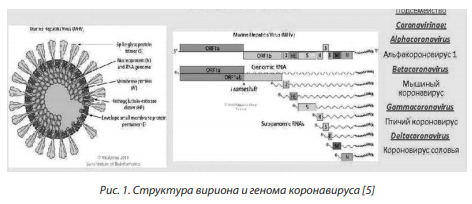
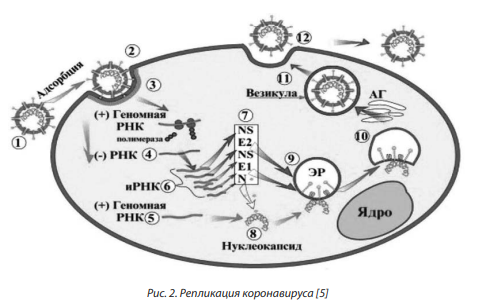
Такие условия, как значительный размер популяции вирусов, их способность заражать при высокой множественности, могут привести к повышению устойчивости вирусных агентов в другом организме, в том числе и макроорганизме. Присущая всем РНК-содержащим вирусам низкая репликативная верность гарантирует, что вирусные популяции могут генерировать и поддерживать мутации, которые позволяют им быстро адаптироваться к изменениям в окружающей среде. Изменчивость и мимолетное существование каждого вирусного генома означает, что популяции РНК-вируса существуют в форме динамических мутантных сетей, в которых секвенции постоянно диверсифицируются и регенерируются путем мутации родственных секвенций. Рисунки 1, 2 отражают типичную структуру вириона и генома коронавируса и его репликационные возможности. Вирион сферический с оболочкой диаметром 120 нм, на поверхности имеющий характерные выпячивания с шишкообразными утолщениями на концах, которые подобно короне, обрамляют вирион. В состав вириона входят несколько полипептидов, включая гликопептиды. РНК-геном связан с белком N, образуя спиральный нуклеопапсид. Геном представляет несегментированную линейную одноцепочечную РНК (+) 27–32 kb, кэпированную и полиаденилированную. Геномная РНК содержит ОРС 1а и ОРС 16. С них транслируются неструктурные белки, которые участвуют в репликации. Структурные белки генерируются посредством субгеномных РНК.
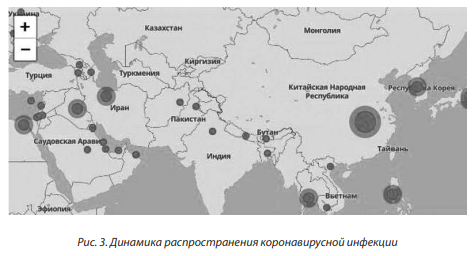
В статье описывается один из представителей РНК-содержащих вирусов — семейство коронавирусов (B97.2). В последние годы все чаще поступают сведения о распространении ранее неизвестной, тяжело протекающей инфекции с поражением легких. Появилась новая разновидность коронавируса, способного вызывать опасное, тяжело протекающее заболевание с эпидемическим распространением [3, 5, 15]. Динамика распространения представлена на карте (рис. 3).
Ю. В. Лобзин с соавт. (2015) включает в это семейство 13 видов респираторных и энтеральных коронавирусов животных и человека [1]. Как природный очаг инфекции рассматривают животных (летучие мыши и верблюды), полагая, что семейство летучих мышей стало инфекционным источником для особей верблюда. У верблюдов болезнь проходит в форме ринита или бессимптомной инфекции [11, 12, 14]. Респираторный КВ человека представлен четырьмя серотипами, а геном — одноцепочечной РНК. Для КВ-инфекций характерно развитие острого профузного насморка, длящегося до 7 дней без повышения температуры, возможны головная боль, кашель, фарингит [14].
Ранее КВ рассматривались как агенты, вызывающие лишь нетяжелые формы заболеваний верхних дыхательных путей с очень редким летальным исходом. В конце 2002 г. был выявлен КВ SARSCoV, являющийся возбудителем атипичной пневмонии, который вызывал ТОРС у людей. Этот вирус был относен к роду Betacoronavirus, в качестве его природного резервуара SARS-CoV служит отряд Microchiroptera (летучие мыши), а промежуточных хозяев — civet (гималайские циветты) и Camelus (верблюды). Всего на протяжении эпидемии в 37 странах мира было зафиксировано свыше 8000 случаев, из них 774 повлекли смертельный исход. С 2004 г. случаи атипичной пневмонии, вызываемой SARS-CoV, не было зафиксировано [2].
Спорным остается вопрос течения этой инфекции у подростков. Первые исследования по детской КВинфекции датируются 2003 г. (Мурадян А.Я. с соавт., 2003). По наблюдениям авторов, сотрудников НИИ гриппа РАМН г. Санкт-Петербурга, случаи с коронавирусной инфекцией и пневмониями (моно или микст), как правило, протекают остро на фоне высокой температуры первых дней заболевания, сопровождаясь адинамией, бледностью и появлением симптомов дыхательной недостаточности. Инфильтрация имеет преимущественно сегментарный характер (1–2 сегмента), чаще в верхней доле правого легкого. Сделан вывод об определенной значимости в этиологическом спектре инфекционной респираторной патологии, не столь уж редкой, обусловленной КВ-инфекцией, особенно актуальной у детей младших возрастов [4].
КВ-инфекции имеют выраженный сезонный характер, в основном распространяясь в течение осенне-зимнего периода. Болезнь обычно носит характер внутрисемейной либо внутрибольничной вспышки. КВ-инфекция распространима контактным, воздушно-капельным или фекально-оральным путями. Как нозокомиальные инфекции вирусной этиологии, КВ превалируют в осеннезимний период, вызывая внутрибольничные вспышки. Как тяжелый острый респираторный синдром, или SARS (Severe Acute Respiratory Syndrom), инфекция впервые была описана Карлом Урбани по наблюдениям в провинции Гуандун (КНР) в 2002 г.
КВ-инфекция протекает как в форме пневмонии, назофарингита, бронхита, так иногда и как шейный лимфаденит. За исключением тяжелых форм пневмонии, интоксикация не выражена. Источники распространения SARSинфекции — человек и представители животного мира (верблюд, барсук, хорек, енот, летучая мышь и пр.) [1,7]. Под воздействием КВ воспаление распространяется на нижние отделы дыхательных путей, что вызывает очаговую пневмонию либо тотальное общее поражение доли или всего легкого. Вирус обладает способностями поражения альвеол, вызывая некроз и фиброз ткани легкого. Рентгенография легких выявляет мультифокальный инфильтрат, склонный к слиянию.
В 10–20 % наблюдений выявляетсяя ОРДС, сопровождающийся тахикардией, сухим кашлем, одышкой, поиженным артериальным давлением, нарастающим рСО2 . Отмечены выраженные расстройства метаболизма с нарастанием острой дыхательной недостаточности. Этот процесс, сопровождающийся явлениями лейко-, тромбоцитопении, повышает активность ферментов печени, креатинкиназы, имеет летальность от 4 до 19,7 % [2]. При поражении бронхолегочной КВ-инфекцией наблюдались также сиптомы поражения желудочно-кишечного тракта в виде рвоты, тошноты, диареи и пр.
Отдельно рассматривается обнаруженный в 2003 г. в Китае новый коронавирус (ТОРС-аКВ), ассоциирующийся с развитием у человека так называемой атипичной пневмонии — тяжелой формы острого респираторного синдрома. Эпидемия, обусловленная ТОРС-аКВ в 2003–2004 гг., стала причиной заболевания более 8000 человек в 29 странах, из которых умерло 900.
Существует еще и т. н. ближневосточный респираторный синдром (БВРС, MERS — Middle Eastrespiratory syndrome) — острое инфекционное заболевание, вызыванное новым коронавирусом (БВРС-КоВ, MERS-CoV), передаваемое животными и человеком, которое характеризуется респираторной инфекцией разной тяжести — от легкой формы до тяжелой. Далее следует пневмония, часто с летальным исходом [2].
Первый подтвержденный случай MERS датируется июнем 2012 г. — 13 июня в Саудовской Аравии (г.Джидда) был госпитализирован 60-летний мужчина, умерший спустя 11 суток со времени начала болезни. Причиной смерти являлись РДС и полиорганная недостаточность.
В сентябре 2012 г. был идентифицирован возбудитель заболевания — новая разновидность коронавируса (БВРС-Ко-В). С того момента постоянно регистрируются заболевания с поражением дыхательных органов, обусловленным данным возбудителем.
Заболевание отмечалось в Саудовской Аравии (85 % всех заболевших), спорадические случаи были выявлены в Катаре, Омане, ОАЭ, Иране, Кувейте, Йемене, Иордании, Египте, Тунисе, Турции; летальность составляла 36 %. Вспышки инфекции были зафиксированы и за рубежами Ближнего Востока — в Германии, Австрии, Италии, Нидерландах, Греции, Франции, Великобритании — в 15 случаях 7 завершились летальным исходом. Последний случай заражения в Европе зарегистрирован в Германии в марте 2015 г., в то же время и в США.
В азиатских странах (Китае, Южной Корее, Малайзии и на Филиппинах) наиболее типично наблюдаемая клиническая картина — повышенная температура тела до 38–39 оС, симптомы головной боли, головокружения, слабости, миалгии, боли в глазных яблоках, легкого озноба, потливости, першения в горле, кашля. В начальный момент болезни кашель сухой без отхождения мокроты, порою изнуряющий, усиливающийся вечером и ночью. У трети пацинтов наблюдали тошноту, диарею, необильную рвоту. В разгар болезни были зафиксированы пневмония, ОРДС, почечная недостаточность, сепсис, полиорганная недостаточность.
История изучения острого респираторного дистресс-синдрома началась с Ashbaugh D. G., Bigelom D. B., Petty T. L. et al., описавших в 1967 г. клинику ОРДС у 12 пациентов при семерых погибших. Тогда была впервые применена терминология «респираторный дистресс-синдром взрослых». ОРДС чем-то схож с болезнью гиалиновых мембран у новорожденных. В дальнейшем такое состояние имело многие названия, включая некардиогенный отек легких, нетравматическое легкое, легкое Дананга, «мокрое легкое», «тяжелое легкое», «шоковое легкое», постранфузионное, постперфузионное легкое.
У этого синдрома важной доминирующей причиной являлись вирусные инфекции. Например, эпидемия атипичной пневмонии (ТОРС, SARS), возникшая в 2002–2003 гг. в Китае и закончившаяся летально для 10 % заболевших; грипп А (H5N1) «птичий грипп» 2003–2006 гг. в Гонконге, во Вьетнаме, в Камбодже, где, по сведениям ВОЗ, переболел 241 человек, 141 из которых погиб; грипп А Н1N1 — пандемия «свиного» гриппа 2009–2010 гг., начавшаяся в Мехико, — смертность 0,2 %; 2019–2020 гг. — эпидемия новой коронавирусной инфекции — на 09.03.2020 летальность 3,5 %.
В этой связи выделяют и группы риска по ОРДС. Это больные с метаболическим синдромом, беременные женщины, особенно в 3-м триместре, с хроническими заболеваниями легких, больные с длительным стажем курильщика свыше 10 лет, а также пациенты с коморбидными состояниями в возрасте старше 65 лет [6].
Диагностика КВ-инфекции. При показателях о каждом случае с подозрением на коронавирусную инфекцию, вызванную вирусом 2019-nCov, больной должен быть подвергнут независимо от вида оказания медицинской помощи комплексу клинического обследования по определению степени тяжести состояния.
Комплекс лабораторной диагностики проводится на основании временных рекомендацй Роспотребнадзора от 21.01.2020 для лабораторной диагностики новой коронавирусной инфекции, вызванной 2019-nCoV. Для лабораторной диагностики инфекции, вызванной 2019-nCoV, применяют метод ПЦР. Метод ПЦР по выявлению РНК 2019-nCoV проводится пациентам с клинической симптоматикой респираторного заболевания с подозрением на инфекцию, вызванную 2019-nCoV, особенно прибывашим с эпидемиологически неблагополучных территорий непосредственно после первичного осмотра, а также контактирующим лицам [2, 3].
Возвращаясь к мутационной устойчивости в поведении РНК-вирусов, возникает вопрос: является ли она препятствием для противовирусной терапии?
Ответ здесь однозначный: ВОЗ порекомендовал при лечении вирусных инфекций применять этиотропные химиопрепараты, блокирующие процесс репликации вируса. При этом противовирусная терапия (ПВТ) назначается как можно ранее с момента первых симптомов, в течение первых 48 ч. ПВТ начинается не дожидаясь лабораторного подтверждения диагноза. К преимуществам ПВТ относится понижение рисков осложнений, сокращение продолжительности лихорадки и прочих симптомов (КЛИНИЧЕСКИ ДОКАЗАНО) [2].
Даже для позднего этапа диагностики ПВТ важна для больных тяжелыми формами вирусных инфекций при осложненном течении [10, 11, 13].
Критический анализ клинического опыта ведения больных с атипичной пневмонией, вызванной коронавирусами SARS-CoV и MERS-CoV, позволил определить некоторые препараты этиологической направленности, как правило, используемые в комбинациях: рибавирин, лопинавир + ритонавир [16]; иммуноглобулины, препараты интерферонов.
Наличие бактериальных осложнений (пневмонии) требует использования респираторных фторхинолонов (у взрослых) [2].
Развитие обструктивного синдрома, или синдрома крупа (у детей), требует начать лечение с использования ингаляционных глюкокортикоидных гормонов, а при сохраняющейся тяжести состояния необходимо продолжать введение гормонов (преднизолона или дексаметазона) парентерально. Для больных ОРДС на фоне РСИ либо при развивающейся тяжелой форме пневмонии КВэтиологии для взрослого требуется использованние сурфактантов эндотрахеально, что способствует процессу восстановления поверхностного натяжения в альвеолах.
lg для внутривенного введения. При наличии тяжелых форм ОРВИ и герпеса lg для внутривенного введения рассматривают с двух позиций: как заместительную терапию для лечения детей при сниженном уровне антител или их дисфункцией; для регуляции или модуляции иммунитета при заболевании, в основе которого лежит тот или иной иммунопатологический механизм.
IFN-препараты — одни из основных при лечении и профилактике вирусных инфекций. Точка приложения для IFN — вирусные мРНК, блокируемые ими, вследствие чего подавляется синтез вирусных белков.
IFN-препараты часто применяются для детей и взрослых в разных формах: свечи, мази, инъекции и т. п. Помимо моновалентных применяются и комбинированные препараты — гриппферон, виферон.
Положительные результаты использования виратицида ремдесивира, о котором недавно сообщили врачи из США, при лечении первого пациента побудил китайских врачей провести два клинических исследования после экспериментов in vitro в клетке. Об этом сообщается в New England Journal of Medicine (2020; doi: 10.1056 / NEJMoa2001191) и Cell Research (2020; doi: 10.1038 / s41422020-0282-0).
Ремдесивир (EC50 0,77 мкМ; CC50 ниже 100 мкМ) и хлорохин (EC50 1,13 мкМ; CC50 ниже 100 мкМ) показали лучшие результаты. Оба средства могут быть пригодны для клинического применения, и, поскольку они уже использовались в клинических исследованиях (ремдесивир) или были одобрены в течение длительного времени (хлорохин), ничто не мешает их допустить к назначению.
Отдельно хочется остановиться на таком отечественном препарате, как Энисамид йодид, коммерческое название «Нобазит». Фармакотерапевтическая группа — противоврусный препарат. Механизм действия — непосредственное влияние на процесс проникновения вирусов в клетку через клеточную мембрану. У данного препарата есть ограничения по возрасту, он применяется только с 18 лет.
Профилактика респираторных инфекций, в том числе и короновирусной, включает в себя использование защитных средств, таких как Назаваль+, препараты альфа-интерферона (капли, спреи, гели, мази) в кратности, равной выходу на улицу. После посещения улицы обязательно промыть нос и ротоглотку физиологически раствором, вымыть руки.
Весь эпидсезон необходимо применять отечественные препараты Анаферон и Эргоферон в дозе по 1 таб. 3 раза в день до 6 мес. В случае появления респираторных проявлений обязательный вызов врача на дом (не посещать поликлинику!), к лечению добавить препараты интерферона альфа в дозах от 1 млн единиц и более.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Conflict of interest.
The authors declare that there is no conflict of interest.


