К наиболее часто встречающимся и широко изученным формам коагулопатий относится гемофилия А (встречается в 80 % случаев, представляет собой дефицит VIII фактора свёртывания), и гемофилия В, связанная с недостатком IX фактора. Гемофилия представляет собой наследственное заболевания, клинические проявления которого встречаются только у мужчин, женщины же могут служить носительницами патологического гена. Для обеспечения нормального гемостаза необходимо, чтобы уровень плазменных факторов свёртывания был не ниже 30 % от нормы. При гемофилии лёгкой степени содержание фактора свёртывания составляет от 5 % до 25 % от нормы, при гемофилии средней тяжести концентрация VIII и IX факторов снижается ниже 5 %, а у пациентов с тяжёлой формой гемофилии содержание плазменных факторов свёртывания опускается ниже 1 % [4].
До 30‑х годов прошлого столетия лечение больных гемофилией ограничивалось иммобилизацией конечностей, наложением тугих повязок и местным применением холода. Всё изменилось, когда больным гемофилией начали использовать для ликвидации дефицита факторов свёртывания переливание сначала цельной крови, а немного позже плазмы, в первую очередь свежезамороженной. В 1964 году был впервые выделен и перелит криопреципитат, представляющий собой концентрат VIII фактора свёртывания, а в 1968 году были выделены другие факторы свёртывания. Однако отсутствие на тот момент каких‑либо методов вирусной инактивации привело к тому, что к концу 80‑х годов практически все больные гемофилией в результате проведенных трансфузий оказались инфицированными вирусами гепатита В и С, а также вирусом иммунодефицита человека. Ситуацию должно было спасти создание факторов свёртывания, полностью безопасных в плане риска передачи инфекционных агентов, и в конце 90‑х годов прошлого века такие препараты были получены с использованием технологии генной инженерии, они получили название рекомбинантных факторов свёртывания. В качестве исходного генетического материала была использована донорская плазма, а в качестве материала для встраивания ДНК — клетки лабораторных животных (в частности, яичники новорождённых хомячков), способных продуцировать VIII фактор. Хранить полученные клетки следует в жидком азоте, в специальном ректоре при температуре -196оС.
После размораживания клетки должны быть помещены в специальный биологический реактор, в котором происходит выделение предшественников FVIII или FIX факторов из клеток в питательный раствор. Затем должна быть обеспечена очистка полученного белка с использованием методов хроматографии. Для обеспечения максимальной безопасности препарата в последнее время в процесс производства препаратов было внедрено проведение ультрафильтрация через нанофильтры [1].
Серьёзной проблемой при проведении заместительной терапии врождённых и приобретённых коагулопатий является формирование ингибирующих антител, представляющих собой иммуноглобулины класса G. О появлении ингибирующих антител говорит факт отсутствия остановки кровотечения после введения адекватно подобранной дозы препарата. Титр ингибиторов измеряется в единицах Бетезда (БЕ) на мл плазмы крови.
Именно с целью коррекции гемостаза при ингибиторных формах гемофилии А и В в 1983 году был разработан и зарегистрирован в странах Европы и Америки рекомбинантный VII фактор свёртывания, впоследствии показания к его применению были расширены до врождённого дефицита VII фактора и тромбастении Гланцманна с резистентностью к переливанию тромбоцитов. При введении данного препарата в присутствии ионов кальция происходит активация X фактора свёртывания непосредственно на поверхности тромбоцитов, что приводит к превращению протромбина в тромбин. Действие рекомбинантного активированного VII фактора свертывания ограничивается почти исключительно местом локального повреждения эндотелия, что теоретически позволяет применять данный препарат в больших дозах без значительного риска развития тромботических осложнений. Наиболее известным рекомбинантным VII фактором свёртывания является препарат NovoSeven, выпускаемый на заводе NOVO NORDISK (Дания). В литературе описаны данные о применении данного препарата при проведении кардиохирургических вмешательств на открытом сердце, в том числе у новорождённых. Группу повышенного риска развития геморрагических осложнений на фоне проведения кардиохирургического вмешательства составляли пациенты со сложными врожденными пороками сердца (ВПС), с длительно существующими приобретёнными пороками сердца, повторно оперируемые на открытом сердце, новорождённые и младенцы с несовершенством гомеостаза, а также больные, которым в дооперационном периоде проводили терапию с применением антикоагулянтов, антиагрегантов, простагландинов, ингаляции оксида азота и других препаратов, снижающих функциональную активность тромбоцитов [5].
Если вначале применение Новосевена ограничивалось ингибиторными формами врождённых гемофилий А и В, то спустя некоторое время его начали активно применять для коррекции гемостаза при приобретенных гемофилиях (патологическом снижении активности факторов свёртывания на фоне системных аутоиммунных процессов, злокачественных новообразований, токсических поражениях печени). Известно о положительном эффекте применения Новосевена при массивных кровотечениях в раннем послеродовом периоде. В 1999 году в журнале «Lancet» был описан случай остановки профузного кровотечения у 19‑летнего израильского солдата, получившего тяжёлое проникающее ранение брюшной полости с разрывов нижней полой вены. Когда на фоне введения большого количества свежезамороженной плазмы, криопреципитата и концентрата тромбоцитов кровотечение не купировалось, было принято решение о болюсном введении Новосевена. В результате интенсивность кровотечения значительно снизилась, а после повторного введения показатели гемостаза практически достигли нормальных цифр. После обнародования данной информации Новосевен стал широко применяться для купирования массивных кровотечений в хирургической и акушерской практике, в частности после операций по поводу резекции кишечника или экстирпации матки [7].
Первый рекомбинантный фактор FVIII был синтезирован в Америке в 1992 году. На сегодняшний день заводом «БАКСТЕР» выпускается препарат «Рекомбинат», а заводом «БАЙЕР» препарат Когенэйт ФС, действующим веществом в обоих случаях является октоког альфа. Рекомбинантный антигемофильный фактор действует аналогично эндогенному VIII фактору свертываемости крови, который является важнейшим компонентом в процессе свертывания крови. Представляя собой кофактор для фактора XI, он способствует ускорению активации фактора X. При этом активированный фактор X способствует преобразованию протромбина в тромбин, который, в свою очередь переводит фибриноген в фибрин, что приводит к образованию сгустка и остановке кровотечения.
Первый рекомбинантный IX фактор свёртывания был выпущен на американском заводе «Пфайзер» под торговой маркой «Бенефикс», действующим веществом в нём является нонаког альфа. Этот препарат представляет собой гликопротеин, экспрессируемый клетками яичников китайского хомячка, подвергнутыми генетической модификации. По принципу действия Бенефикс аналогичен плазменному IX фактору свёртывания, но нескольку уступает ему в активности. Активированный фактор свертывания крови IX в комбинации с активированным фактором свертывания крови VIII приводит к активации фактора свертывания крови Х, что, в свою очередь, обеспечивает превращение протромбина в тромбин, а фибриногена в фибрин с дальнейшим формированием кровяного сгустка. Основным показанием к применению как плазменного, так и рекомбинантного IX фактора свёртывания является гемофилия В, препарат вводится как с терапевтической, так и профилактической целью для предупреждения массивного кровотечения во время оперативного вмешательства [6].
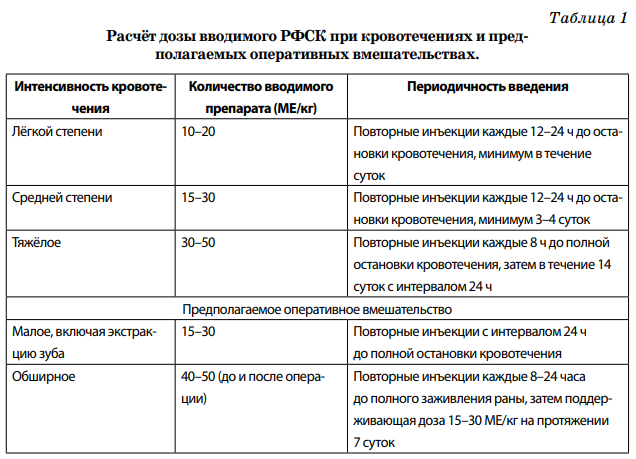
Полученные методом генной инженерии факторы свёртывания представляют собой лиофильный порошок, предназначенный для растворения в специальном растворе (5 мл 0,9 % раствора хлорида натрия) для последующего внутривенного введения, содержащий от 250 до 2000 МЕ активного вещества. Данный раствор должен быть введен через 5–10 минут после получения. Считается, что 1 МЕ активного вещества на 1 кг массы тела способна увеличить на 2 % активность дефицитного фактора свёртывания. Для коррекции ранней стадии гемартрозов, небольших кровоизлияний в мышечную ткань рекомендуется увеличение активности VIII фактора свёртывания до 20– 40 %, при более выраженных гемартрозах и гематомах до 30–60 %, при тяжёлых кровотечениях и угрожающих жизни состояниях активность VIII фактора должна быть увеличена на 60–100 %. В табл. 1 приведены дозы и кратность введения рекомбинантного фактора свёртывания.
Рекомбинантный фактор свёртывания крови VIII, так же как и эндогенный, принимает активное участие во внутреннем механизме свёртывания крови, образуя в присутствии тромбоцитарных фосфолипидов и ионизированного кальция комплекс с фактором свёртывания крови IX. Данный комплекс приводит к активации X фактора свёртывания, обеспечивающий преобразование протромбина в тромбин, который, в свою очередь, превращает фибриноген в фибрин, что приводит к образованию кровяного сгустка [3].
В России рекомбинантные факторы свертывания были впервые произведены в 2010 году закрытым акционерным обществом «ГЕНЕРИУМ». Первым был выпущен рекомбинантный VII фактор для лечения ингибиторных форм гемофилии, который получил название «Коагил-VII», в 2012 году был выпущен «Октофактор», представляющий собой полученный рекомбинантным путём VIII фактор свёртывания, годом позже был получен рекомбинантный FIX, получивший название «Иннонафактор». Таким образом, в РФ выпускается полная линейка рекомбинантных факторов, предназначенных для лечения и профилактики кровотечений при гемофилии. Проведенные исследования показали, что данные препараты хорошо переносятся больными и практически не вызывают тромбогенных, иммуногенных и аллергических реакций [2].
КОНФЛИКТ ИНТЕРЕСОВ
Автор заявляет об отсутствии конфликта интересов при написании статьи.
CONFLICT OF INTEREST
The author declare no conflict of interest involved in preparation of the article.


