Введение
Рак прямой кишки (РПК) представляет собой одну из актуальных и сложных проблем современной онкоколопроктологии. Распространенность и смертность населения от этой патологии по-прежнему остаются высокими. Так, только в России в 2014 г. зарегистрировано 26 785 новых случаев рака прямой кишки, а смертность составила 9,2 %. В структуре онкологической заболеваемости рак прямой кишки занимает 6-е место (5,2 %) среди мужчин и 7-е место (4,7 %) среди женщин [4 ].
В ряду колоректальных раков особое место занимают раки прямой кишки низких локализаций (ниже 6 см), при лечении которых применяются комбинированные методы лечения, а частота местных рецидивов, несмотря на выполнение зачастую инвалидизирующих операций, значительно выше.
Особенности МР-анатомии аноректальной области
Аноректальная область является той зоной, где формируется основная проктологическая патология. В этой области выделяют анальный канал, идущий от кожи перианальной области до «зубчатой линии», выше которой начинается слизистая прямой кишки. Длина анального канала составляет от 1,5 до 3 см. Иногда выделяют «хирургический анальный канал», он несколько длиннее — до 5 см, идет выше зубчатой линии и достигает аноректального кольца, образованного пуборектальной мышцей, за счет чего кишка в этом месте меняет свое направление. Дистальной границей анального канала служит анальное отверстие, где граничат кожный покров перианальной области и эпителиальная выстилка анального канала, или анодерма, представленная многослойным плоским неороговевающим эпителием. На МРТ анальное отверстие отдельно не визуализируется, однако его уровень совпадает с дистальной границей мышечных волокон наружного сфинктера. Наиболее информативной для визуализации уровня анального отверстия является сагиттальная плоскость (рис. 1).
Границей между анальным каналом и собственно прямой кишкой является «зубчатая линия», ее можно увидеть во время ректоскопии, но нельзя определить при пальпации. Зубчатая линия образована на месте эмбриональной мембраны и имеет большое значение. Анатомически зубчатая линия представляет зону смыкания многослойного плоского эпителия анодермы и однослойного цилиндрического или кубовидного эпителия слизистой оболочки прямой кишки. Зубчатая линия не видна на МРТ, однако ее уровень можно определить по окончанию так называемых анальных столбов — вертикальных складок слизистой оболочки, в синусах между которыми располагаются устья анальных желез (крипты). Ниже зубчатой линии иннервация осуществляется соматической нервной системой (все манипуляции в этой области болезненные для пациента), а выше — вегетативной нервной системой (слизистая не чувствительна к манипуляциям). Выше зубчатой линии кровоснабжение осуществляется из системы верхних и средних геморроидальных сосудов, ниже — из системы нижних геморроидальных сосудов. Анальные столбы оптимально визуализируются на сагиттальных Т2-взвешенных изображениях (рис. 1).
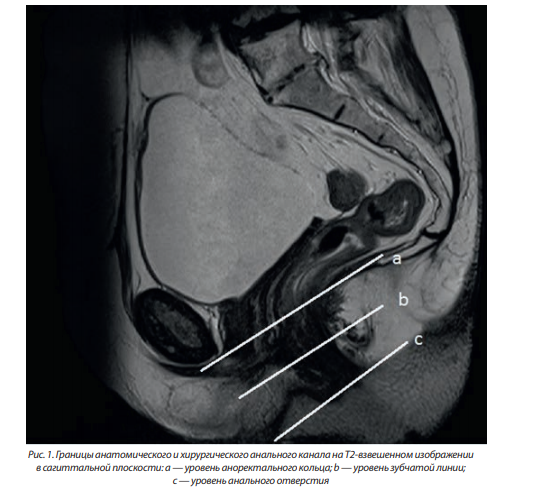
Проксимальной границей хирургического анального канала служит аноректальное кольцо, располагающееся на уровне лобково-прямокишечной мышцы и дистального леватора ануса. На уровне аноректального кольца прямая кишка формирует изгиб кзади — аноректальный угол (рис. 1).
Выше зубчатой линии анальный канал переходит в прямую кишку, слизистая которой выстлана цилиндрическим однослойным эпителием. Длина прямой кишки вместе с анальным каналом 14–18 см. Сразу выше зубчатой линии имеется 8–14 вертикальных складок — морганиевых колонн длиной 2–4 см. В основе этих валиков лежат гладкомышечные волокна. Колонны в нижней части соединены остатками анальной мембраны, носящими названия полулунных морганиевых заслонок, между которыми маленькие углубления — анальные синусы (крипты Моргани). В области крипт имеются протоки анальных желез, которые вырабатывают слизь. Количество их составляет 4–12, преимущественно железы располагаются по задней полуокружности анального канала и имеют трубчатоальвеолярное строение.
Мышечные структуры прямой кишки представлены внутренним и наружным сфинктерами. Внутренний сфинктер протяженностью 2,5–4 см, образован утолщением дистальной части внутреннего циркулярного слоя мышечной оболочки прямой кишки и является его продолжением. Он представлен гладкой мышечной тканью и визуализируется на корональных изображениях в виде слоя толщиной 0,3–0,4 см. Внутренний гладкомышечный сфинктер окружен наружным сфинктером, состоящим из поперечно-полосатых мышц. Пальпаторно можно определить границу между внутренним и наружным сфинктерами в виде межфасциальной борозды. Поверхностный слой наружного сфинктера сзади прикреплен к заднепроходно-копчиковой связке, а глубокий слой является продолжением лобково-прямокишечной мышцы.
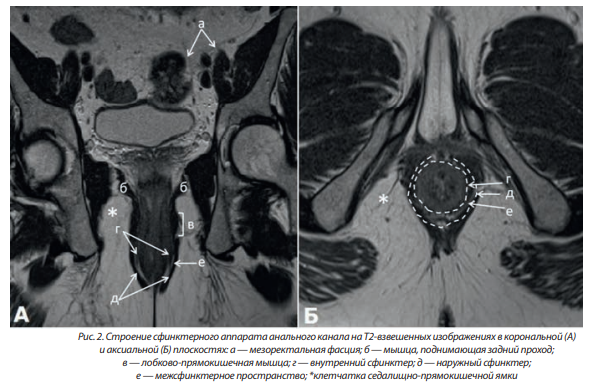
Между внутренним и наружным сфинктером расположено межсфинктерное пространство, образованное наружной продольной мышцей прямой кишки (мышцей Трейца). Порции этой мышцы пронизывают внутренний сфинктер и заканчиваются в подслизистом слое прямой кишки. Морфологически он представляет собой клетчатку и содержит терминальные волокна продольного слоя собственной мышечной оболочки прямой кишки. Наиболее отчетливо этот слой визуализируется на корональных Т2-взвешенных МР-изображениях в виде светлой полоски толщиной 0,1–0,2 см (рис. 2).
Внешняя мышечная оболочка анального канала состоит из поперечнополосатой мышечной ткани; в верхней части она представлена волокнами лобково-прямокишечной мышцы, а в нижней — наружным сфинктером. Лобково-прямокишечная мышца является главным компонентом сфинктерного комплекса; она представляет собой утолщение мышц тазового дна протяженностью ~1,0 см на уровне дистального прикрепления мышц, поднимающих задний проход, и больше выражена у мужчин. Волокна лобково-прямокишечной мышцы вплетены в воронкообразную дистальную часть m. levator ani, которая, в свою очередь, прикрепляет сфинктерный комплекс к стенкам таза.
Спереди к анальному каналу прилежит пузырно-прямокишечная фасция (или фасция Денонвилье), которая отделяет от него предстательную железу и уретру у мужчин, или влагалищно-прямокишечная фасция у женщин. Взаимоотношения анального канала и расположенных спереди от него структур хорошо визуализируются на сагиттальных и аксиальных МР-изображениях, ориентированных строго поперек длинника анального канала. Анальный канал прикреплен к копчику при помощи заднепроходнокопчиковой связки [3, 6].
Стадирование рака прямой кишки
Основой для оценки местной распространенности опухолей прямой кишки служит критерий «Т» классификации злокачественных опухолей TNM [2 0]. Согласно этой классификации выделяют следующие стадии местной распространенности колоректального рака:
– Tis (опухоль in situ) — опухоль в пределах слизистой оболочки, не распространяется за ее базальную мембрану;
– ТІ — опухоль прорастает мышечный слой слизистой оболочки (muscularis mucosae) и распространяется в подслизистый слой;
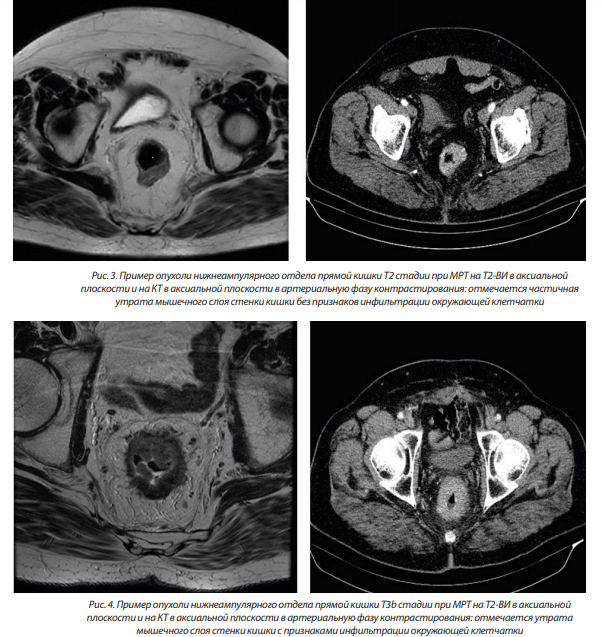
– Т2 — опухоль прорастает подслизистый слой и распространяется в мышечную оболочку;
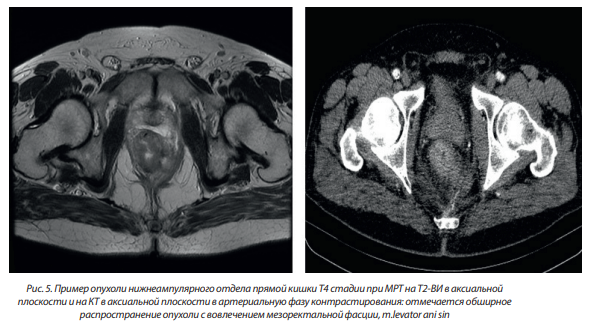
– ТЗ — опухоль прорастает мышечную оболочку и выходит за пределы стенки прямой кишки в мезоректальную клетчатку (в забрюшинных отделах) или субсерозную оболочку (в перитонизированной части);
– Т4а — опухоль прорастает в висцеральную брюшину;
– Т4b — инвазия в другие тазовые органы.
– Следует подчеркнуть, что в TNMклассификации по единым критериям стадируются опухоли ободочной и прямой кишки, особенности стадирования рака нижнеампулярного отдела прямой кишки и анального канала не учтены. В приведенной классификации среди критериев стадирования также отсутствуют такие показатели, как глубина инвазии опухоли в мезоректальную клетчатку, интактность мезоректальной фасции и наличие экстрамуральной сосудистой инвазии, что учитывается при выборе оптимальной тактики лечения [52].
– Учитывая особенности анатомии аноректальной области, местное TNMстадирование рака анального канала осуществляется по иным критериям, главным из которых является размер опухоли: – Tis (опухоль in situ) — опухоль в пределах слизистой оболочки, не распространяется за ее базальную мембрану;
– ТІ — опухоль прорастает за пределы слизистой оболочки, имеет размер не более 2 см;
– Т2 — опухоль прорастает за пределы слизистой оболочки, имеет размер более 2 см, но менее 5 см;
– ТЗ — размер опухоли превышает 5 см;
– Т4 — опухоль прорастает в соседние органы — влагалище, уретру, мочевой пузырь (прямая инвазия в стенку прямой кишки, перианальную кожу и подкожную клетчатку и сфинктеры не относится к Т4 стадии).
Очевидно, что в классификации не учтены критерии повреждения сфинктерного аппарата, межсфинктерного пространства и мышц тазового дна.
Примеры опухолей различной Т стадии приведены на рис. 3–5.
В настоящее время терапией первой линии при нижнеампулярном раке прямой кишки и раке анального канала является химиолучевая терапия [7, 13]. Приблизительно у 42 % пациентов при этом удается достичь полного регресса опухоли [7]. При недостаточной эффективности консервативной терапии, т. е. при сохранении опухолевой ткани, пациентам выполняется брюшно-промежностная экстирпация прямой кишки и анального канала [9, 10]; при этом оперативное лечение может носить сфинктеросохраняющий характер, если опухоль не выходит за пределы внутреннего сфинктера [10, 11].
Таким образом, для планирования оперативного лечения помимо стадирования по системе TNM важной является оценка взаимоотношения опухоли с составляющими сфинктерного аппарата анального канала — наружным и внутренним сфинктером, а также межсфинктерным пространством [12, 14–17].
Лучевая диагностика
Диагноз РПК обычно устанавливают с помощью пальцевого исследования, эндоскопического исследования (ректороманоскопия, колоноскопия), ирригоскопии (методика двойного контрастирования) и гистологического подтверждения.
Однако названные методы не позволяют в достаточной мере выявить степень инвазии опухолевого процесса в стенку прямой кишки, вовлечения лимфатических узлов и паренхиматозных органов брюшной полости в метастатический процесс, что является важным в выборе оптимальной лечебной тактики и прогностическим критерием течения заболевания.
Рентгеновский метод исследования прямой кишки, зарекомендовав себя как один из основных методов в определении протяженности опухолевого процесса по стенке кишки, также имеет свои недостатки. Ирригоскопия с использованием искусственной гипотонии и двойного контрастирования повышает точность обычной методики с 62 до 87 % при определении формы роста рака прямой кишки и с 76 до 91 % при установленной внутриорганной протяженности [2, 8].
Все вышеперечисленные методики не дают полной картины поражения кишечной стенки, параректальной клетчатки и лимфатических узлов.
Компьютерная томография
Рентгеновская компьютерная томография еще несколько десятилетий назад применялась в качестве единственного метода оценки местной распространенности опухоли, состояния регионарных лимфатических узлов и скрининга отдаленных метастазов [6].
Однако, по мнению некоторых авторов, в аспекте оценки местной распространенности рака прямой кишки диагностические возможности метода остаются невысокими. По результатам метаанализа 83 публикаций, посвященных стадированию рака прямой кишки, чувствительность КТ в Т-стадировании опухолевого процесса составляет 78 %, специфичность 63 % и точность 73 % [5].
Для элиминации артефактов, обусловленных перистальтикой кишки, некоторые авторы рекомендуют выполнять исследование в положении пациента лежа на животе с использованием ингибиторов перистальтики (бускопан или глюкагон ) [1]. Для улучшения тканевой дифференцировки исследование может дополняться эндоректальным введением геля, однако даже при этом метод не позволяет достоверно оценить местную распространенность опухолей прямой кишки, за исключением случаев массивной инвазии смежных органов [23].
Мультиспиральная компьютерная томография (МСКТ) не позволяет, по мнению большинства исследователей, адекватно определить степень инвазии опухоли. Это связано со слабым разрешением изображения МСКТ при исследовании мягких тканей малого таза и невозможностью четкой визуализации всех слоев кишечной стенки. Заподозрить опухолевую инфильтрацию соседних органов можно по косвенным признакам в виде истончения слоя параректальной клетчатки [15]. Имеются данные метаанализа, которые определяют чувствительность МСКТ в оценке местного распространения рака прямой кишки на уровне 72–79 %, а специфичность — 78–96 % [13]. Основным критерием определения статуса тазовых лимфоузлов при МСКТ является их размер, что часто приводит к диагностическим ошибкам, так как 95 % метастатических лимфоузлов имеют размер менее 5 мм, а 50 % — меньше 3 мм. Таким образом, при диагностике поражения параректальных лимфоузлов точность метода МСКТ составляет всего 61,5 % [47].
В исследовании пациентов до и после оперативного лечения рака прямой кишки МСКТ находит широкое применение в диагностике распространенности опухолевого процесса, наличия отдаленных метастазов, ранних послеоперационных осложнений, тогда как дифференциация рецидивов и воспалительных изменений данным методом затруднительна.
Большую сложность вызывает оценка состояния структур малого таза на этапах комбинированного лечения РПК, особенно дифференциальная диагностика различных анатомических изменений в условиях постлучевого фибро за [6].
Магнитно-резонансная томография
Магнитно-резонансная томография является диагностическим методом, сочетающим в себе преимущества пространственного и контрастного разрешения в сочетании с отсутствием лучевой нагрузки.
Для низких локализаций рака прямой кишки неоспорима диагностическая роль МРТ в прогнозировании вовлечения латерального края резекции, так как на уровне мышц, поднимающих задний проход, толщина мезоректума значительно тоньше, чем в верхне- и среднеампулярных отделах прямой кишки [45, 61]. Высокое пространственное разрешение МР-изображений в коронарных плоскостях позволяют четко визуализировать леваторы ануса, комплекс внутренних и наружных сфинктеров и межсфинктерное пространство, что используется для стадирования низких колоректальных опухолей и планирования объема хирургического вмешательства (стандартная операция, сфинктеросохраняющая резекция, экстралеваторная брюшно-промежностная экстирпация прямой кишки) [53–57].
В ранних работах исследовалась информативность МРТ с эндоректальной катушкой, которая обеспечивает высокое пространственное разрешение и возможность четкой детализации стенок прямой кишки, однако малое поле обзора затрудняет оценку собственной фасции, окружающих структур и лимфатических узлов, что приближает диагностическую эффективность метода к ЭУЗИ. Существенным ограничением является невозможность применения метода при стенозирующих и высоко расположенных процессах, а также дороговизна эндоректальных катушек.
На сегодняшний день методом выбора для первичной диагностики рака нижнеампулярного отдела прямой кишки является МРТ с фазированными поверхностными катушками. Появление последних позволило добиться высокого пространственного разрешения в сочетании с большим полем обзора, что обеспечило возможность визуализации структур до 1–2 мм в диаметре на большом протяжении [35, 42, 43, 59].
Польза контрастирования препаратами гадолиния многими авторами оспаривается, так как она не улучшает оценку местной распространенности. Кроме того, так как повышение контрастности требует подавления сигнала от жировой ткани, это приводит к снижению соотношения сигнал-шум и потенциальному «завышению» стадии опухоли из-за усиления сигнала от соседних доброкачественных структур, таких как сосуды, появлению десмопластической реакции стромы и нормальных лимфоузлов. В отличие от других авторов, Чжан и др. показали, что подавление сигнала от жира приводит к повышению динамической контрастности и является лучшим методом, чтобы определить края опухоли [9, 19].
В настоящее время общепринятым методом проведения МРТ-исследования прямой кишки является протокол, предложенный С. С. Балясниковой, Е. Л. Дроновой и включающий:
– TSE T2 cor, large FOV;
– TSE T2 oblique sag, small FOV;
– TSE T2 oblique axial, small FOV;
– DWI c b-факторами 0, 800, 1000 с/мм2;
– 2D T1 TSE axial;
– TSE T2 cor small FOV при локализации опухолей в анальном канале и нижнеампулярном отделе прямой кишки [8].
При данной методике проведения исследования не рекомендуется как внутрипросветное контрастирование прямой кишки, так и внутривенное контрастирование с применением парамагнетиков.
По мнению рядя авторов, бесконтрастные T1-взвешенные изображения имеют ограниченную ценность в определении отношения опухоли по отношению к слоям кишечной стенки, однако другие исследователи утверждают, что после внутривенного введения парамагнитного контраста гладкие мышцы внутреннего сфинктера усиливаются, что может быть полезно для изучения взаимоотношения опухоли к сфинктерному комплексу при дистальных раках прямой кишки и опухолях анального канала [12, 16].
Также нет единого мнения среди авторов о применении последовательности с препаратами гадолиния: S. Balyasnikova, D. Tait, G. Brown утверждают, что данные последовательности неинформативны для определения T стадии и оценки латерального края резекции, в то время как Wieder H. А. и его команда исследователей отмечают, что для исключения инфильтрации анатомических структур, расположенных рядом, МРТ с применением препаратов гадолиния значительно повышает точность исследования [60].
Работа по стадированию первичных ректальных опухолей низкой локализации, проведенная группой японских исследователей с комплексным применени ем эндоректального контрастирования водой, диффузионно-взвешенных последовательностей на высоких значениях b-факторов и динамического внутривенного контрастного усиления, показала, что T- и N-стадирование опухолей с использованием только ДВИ и обработки изображений с эндоректальным контрастированием водой является недопустимым [36, 41].
Тем не менее комбинированное применение динамической контрастной МРТ, ДВИ и изображения с контрастированием водой просвета прямой кишки является более точным для постановки T и N стадии опухолей, чем полученные с помощью только рутинных МРТпоследовательностей [40, 62].
Несмотря на более чем двадцатилетний опыт использования, основные МРпоследовательности при раке прямой кишки до сих пор не стандартизированы, методика же исследования опухолей низкой локализации, таких как раки нижнеампулярного отдела прямой кишки и анального канала, отдельно не рассматривалась, стандартизированного протокола МРТисследования пациентов с данным видом патологии не разработано.
Т2-взвешенные изображения с высоким пространственным разрешением чаще всего применяются при первичной диагностике рака прямой кишки, а также на этапах лечения и являются методом выбора для оценки анатомии ректальной стенки [21]. Выявление опухоли основывается на естественной разности интенсивности МР-сигнала между неизмененной кишечной стенкой, прилежащими структурами и тканью опухоли. На Т2-взвешенных изображениях опухоли прямой кишки, как правило, имеют промежуточную интенсивность сигнала между параректальной жировой клетчаткой и мышечным слоем. Необходимо отметить, что интенсивность сигнала опухоли увеличивается, если образование содержит муцин, и снижается при наличии десмопластической реакции. Собственная фасция прямой кишки хорошо визуализируется на Т2-взвешенных изображениях как тонкая гипоинтенсивная структура на фоне высокоинтенсивной параректальной клетчатки, однако из-за уменьшающейся толщины параректальной клетчатки на уровне нижнеампулярного отдела оценка может быть затруднена [35, 42, 43].
Показатели диагностической эффективности МРТ в определении опухолевой инфильтрации собственной фасции прямой кишки составляют: чувствительность — 75 %, специфичность — 88–98 %, точность — 85–92 % [23, 51].
Одним из важных количественных критериев в правильной оценке распространенности РПК является латеральный край резекции, который равен расстоянию от края опухоли до собственной фасции прямой кишки. По данным ряда авторов, этот показатель является более надежным прогностическим фактором, чем Т стадия. Некоторые авторы полагают, что наличие довольно тонкого слоя периректального жира на уровне нижнеампулярного отдела прямой кишки может ограничивать способность МРТ визуализировать переднюю мезоректальную фасцию. Кроме того, близость к нижней передней стенке прямой кишки семенных пузырьков у мужчин и задней стенки влагалища у женщин может приводить к снижению точности МРТ в выявлении участия потенциального края резекции при низких передних опухолях прямой кишки [44, 53].
Однако в целом совпадение данных предоперационной МРТ и результатов послеоперационного морфологического исследования латерального края резекции достигает 92 % [6].
Несмотря на высокое пространственное разрешение, основные диагностические трудности при МРТ-исследовании возникают при дифференциации между T2 и T3 стадиями опухоли. Основной проблемой МРТ является превышение стадии опухоли за счет десмопластической реакции в неопухолевых структурах, расположенных близко к краю опухоли, что мешает дифференцировать фиброзные изменения в параректальной клетчатке и истинную опухолевую инфильтрацию [42]. В то же время специфичность МРТ при Т4 стадии очень высокая — 96 % [14].
Метастатическое поражение параректальных лимфатических узлов (ПЛУ) является индикатором вероятности отдаленного метастазирования, местного рецидива процесса и показанием для назначения неоадъювантной химиолучевой терапии [34, 46]. При этом адекватная радиологическая оценка лимфогенного распространения РПК остается нерешенной проблемой.
Наиболее часто используемым критерием для определения метастатического поражения лимфоузла является его увеличение, однако у этого подхода есть существенные ограничения, вызванные возможной доброкачественной лимфоидной гиперплазией или наличием микрометастазов в неувеличенных параректальных лимфоузл ах [33]. Ряд авторов предложили в качестве критерия метастатического поражения оценивать контуры и интенсивность МР-сигнала. Они пришли к выводу, что присутствие спикулоподобной реакции, нечеткость контуров узла и неоднородность интенсивности сигнала повышают информативность метода. Использование указанных диагностических маркеров повышает специфичность метода от 68 % (оценка только размера лимфоузла) до 97 % [1].
Однако результаты метаанализа показывают, что никакой из методов неинвазивной визуализации не обладает достаточной диагностической точностью для определения метастатически измененных параректальных лимфоузлов. Ряд авторов проводили экспериментальные исследования в области использования МРТ с динамическим контрастированием для определения метастатического поражения лимфатических узлов при раке прямой кишки, однако использование таких последовательностей не нашло до настоящего времени применения в повседневной клинической практике [27–32].
Развитие визуализационных методик при раке прямой кишки достигло большого прогресса в улучшении пространственного и контрастного разрешения, увеличении скорости получения данных, а также в возможностях сложной постобработки с получением трехмерных изображений и многоплоскостного моделирования, благодаря чему обеспечивается превосходная анатомическая детализация. Однако для более полноценного диагностического анализа местной распространенности рака прямой кишки необходима оценка функциональных параметров.
Одним из перспективных направлений является МРТ-диффузия, которая позволяет оценивать физиологические параметры тканей на основании регистрации скорости внутри- и внеклеточной диффузии молекул. Оценка диффузионной МРТ может быть как визуальной, основанной на разности интенсивностей МР-сигнала, так и количественной — с расчетом кажущегося коэффициента диффузии (ADC) [36, 41].
Функциональные параметры могут быть получены путем применения диффузионно-взвешенных изображений для оценки показателей микроструктурной организации ткани, таких как плотность клеток, целостность клеточных мембран и в конечном счете жизнеспособность клеток [58]. Согласно исследованиям Attenberger, измерения коэффициента диффузии были полезны в дифференциации N стадии опухоли [7]. Дифференцировка метастаз-положительных и метастаз-отрицательных лимфатических узлов на ДВИ ограничена, поскольку неметастатические лимфатические узлы в некоторых случаях также могут давать сигнал высокой интенсивности [32].
На поздних стадиях колоректального рака реактивно-воспалительное увеличение лимфатических узлов является общим и может привести к ложно-положительным результатам на ДВИ-МРТ [12], тогда как на ранних стадиях рака реактивного увеличения лимфатических узлов не происходит, и поэтому ДВИ сигнал высокой интенсивности для лимфатического узла в случае раннего рака прямой кишки более вероятно связан с его метастатическим поражением [24–26].
Точность МРТ в оценке вторичного поражения мезоректальных лимфатических узлов остается умеренной, так как нет надежных критериев оценки метастатически пораженных лимфоузлов. Одним из наиболее перспективных достижений МРТ может быть использование новых лимфографических агентов, которые помогают оценить распространение опухоли в лимфатические узлы. В недавнем исследовании МРТ с гадовистом улучшило специфичность узлового стадирования с 82 %, достигнутых со стандартной МРТ, до 97 % [31].
Сочетание диффузионно-взвешенной МРТ с Т2-взвешенными изображениями улучшает идентификацию тазовых лимфатических узлов по сравнению с одними только Т2-взвешенными изображениями. Использование сочетания изображений позволило обнаружить 29 % дополнительных узлов по сравнению с одними только Т2-взвешенными изображениями [37].
Heijnen и Seber показали, что ДВИ увеличивает точность выявления пораженного лимфатического узла. ДВИ с измеряемым коэффициентом диффузии может играть определенную роль в характеристике лимфатического узла, но как единственный метод диагностики МРТ не является надежным для дифференциации доброкачественных и злокачественных узлов [22, 51]. Кроме того, Бурдан и соавт. показали возможность получить функциональную информацию о метастатическом поражении тазовых лимфоузлов в виде увеличения сигнала на диффузионно-взвешенных изображениях и низкого значения коэффициента диффузии, а не основываясь на размере лимфоузла [17, 18]. Даже притом что ДВИ вместе с ИКД-картами очень полезны в выявлении очагов поражения, они не могут быть применены в качестве маркеров злокачественности без применения классических Т1- и Т2-взвешенных последовательностей [39, 48, 54].
Таким образом, уже показана потенциальная ценность диффузионно-взвешенных изображений МРТ в первичной диагностике колоректального рака, есть указания на эффективность диффузионной МРТ в выявлении опухолей прямой кишки маленького размера, а также при визуализации местного реци дива [38]. Показана высокая диагностическая эффективность МРТ-диффузии в выявлении первичного рака прямой кишки (чувствительность — 93–95 %, специфичность — 95–100 %).
Заключение
Адекватное стадирование и оценка распространенности рака нижнеампулярного отдела прямой кишки и анального канала на основании комплексной лучевой диагностики позволяет индивидуально подходить к выбору оптимальной тактики предстоящего лечения больных.
Несмотря на свои ограничения в возможности оценки вторичного поражения лимфоузлов и ряд нерешенных вопросов по оптимизации протокола исследования больных с раками низкой локализации, МРТ на сегодня является единственным методом, который позволяет определять отношение латерального края опухоли к мезоректальной фасции, ее взаимосвязь с окружающими структурами и органами малого таза и, исходя из этого, отбирать пациентов в соответствии с тактикой предстоящего лечения. МРТ позволяет более корректно планировать лечение и тем самым улучшать показатели общей выживаемости больных раком низких локализаций.


