Наиболее частым осложнением аневризм головного мозга является нетравматическое субарахноидальное кровоизлияние (САК), сопровождающееся излитием крови под паутинную оболочку и распространением по базальным цистернам, бороздам конвекситальной поверхности мозга в межполушарную и латеральную щели. Источник и интенсивность кровоизлияния определяют характер распространения крови по субарахноидальным пространствам — оно может быть локальным либо заполняющим все субарахноидальные пространства с образованием сгустков крови в цистернах и прорывом в желудочковую систему и паренхиму мозга [17]
Кровь, излившаяся в субарахноидальные цистерны, запускает каскад реакций, приводящий к сужению и изменению стенок интракраниальных артерий, именуемый церебральным ангиоспазмом (ЦА). Рентгенологически ангиоспазм выявляют в 60–70 % случаев аневризматического САК. В 2/3 случаев ангиоспазм ведет к развитию ишемии головного мозга, обусловливающей транзиторный или постоянный неврологический дефицит. В подобных случаях говорят о симптоматическом ангиоспазме (или отсроченной ишемии головного мозга) [4, 17].
Церебральный ангиоспазм часто сопровождается высоким риском развития летальности и инвалидизации, при этом риск развития неблагоприятных исходов выше, чем при повторном разрыве аневризмы и других осложнениях САК [1, 6].
Высокие показатели летальности и инвалидизации, вызванные развитием ангиоспазма, определяют необходимость раннего прогнозирования и предотвращения этого осложнения [5].
Одним из наиболее информативных методов диагностики в остром периоде нетравматического САК (первые 14 суток) является рентгеновская компьютерная томография (КТ) [3]. Высокая чувствительность компьютерной томографии в диагностике любых видов кровоизлияний обусловлена повышенной абсорбцией рентгеновских лучей белковой фракцией гемоглобина, вследствие чего на полученных изображениях САК выглядит как содержимое повышенной плотности в цистернах основания и конвекситальных бороздах головного мозга. В результате смешивания компонентов крови с цереброспинальной жидкостью и распада белков гемоглобина степень абсорбции рентгеновских лучей в месте кровоизлияния быстро уменьшается, и уже через 2–3 дня кровь в базальных цистернах при КТ может не обнаруживаться [2].
Впервые связь между церебральным ангиоспазмом и визуализацией сгустков крови в базальных субарахноидальных цистернах на первичных компьютерных томограммах была описана Takemae et al. в 1978 г. [24]. Первую попытку систематизировать КТ-данные и выработать классификацию САК в зависимости от риска развития клинически значимого ангиоспазма предпринял Davis J. с соавт. в 1980 г. на основе данных исследования 50 пациентов [8].
Авторы анализировали данные КТ, выполнявшейся в первые 4 суток после развития САК; по выраженности кровоизлияния выделили 4 степени (табл. 1). Было установлено, что у 64 % пациентов с выраженным ангиоспазмом и ишемическими изменениями в ткани головного мозга кровоизлияние соответствовало третьей или четвертой степени. Однако Davis J. и соавт. не предложили четкие количественные критерии, позволяющие дифференцировать минимальное, умеренное или выраженное кровоизлияние, что затрудняло использование классификации в рутинной практике [8].

С 1980-х гг. начались многочисленные попытки прогнозирования развития ЦА; разрабатывались новые и совершенствовались имеющиеся классификации [19]. В настоящее время большинство споров идут о предиктивной ценности классификаций, оценивающих наличие крови в базальных субарахноидальных цистернах и внутри желудочков головного мозга. Общеизвестно, что паренхиматозный компонент крови в меньшей степени влияет на развитие ЦА, поэтому в этой статье не освещены классификации, оценивающие внутримозговые кровоизлияния.
Спустя два года после опубликования работ Takemae T. и соавт. появилась наиболее распространенная в настоящее время шкала, предложенная Fisher C.M. с соавт. в 1980 г. Авторы оценивали компьютерные томограммы в первые 5 суток после разрыва аневризмы головного мозга, определяли заполнение кровью субарахноидальных пространств и, разделив всю когорту пациентов на 4 группы, выявили корреляцию между частотой развития ЦА и выраженностью базального САК. У пациентов из третьей группы при наличии сгустков крови более чем 1 мм толщиной в вертикально расположенных субарахноидальных цистернах по данным КТ церебральный ангиоспазм развился в 100%; в 96% наблюдений ангиоспазм был выраженным (по данным церебральной ангиографии) с возникновением вторичной ишемии головного мозга [11]. У пациентов с диффузным распространением САК (тонким слоем) или при отсутствии крови в цистернах (1, 2 и 4 групп) выраженный ангиоспазм наблюдали только в 9% по данным ЦАГ. В этой группе пациентов ангиоспазм не проявлялся клинически.
Kistler J.P. и соавт. (1983) провели проспективное исследование, в основу которого положены результаты обследования 41 пациента, и подтвердили предшествующие выводы [18]. 20 из 22 пациентов с массивным базальным САК перенесли выраженный АС, в то время как у 14 из 19 пациентов с тонким слоем или отсутствием крови в базальных цистернах либо с наличием крови вне базальных САЦ выраженный АС не развился.
Классификация Fisher-Kistler очень быстро вошла в практику и до настоящего времени остается одной из наиболее часто используемых шкал для оценки распространенности и тяжести аневризматического САК по данным КТ. Удобство шкалы заключается в простоте ее использования, наличии четких диагностических критериев и высокой прогностической ценности (табл. 2).

Примечание: 1фронтальная межполушарная цистерна, островковая цистерна, охватывающая цистерна; 2ножка сильвиевой щели, сильвиевая цистерна, межножковая цистерна, базальная фронтальная межполушарная цистерна.
Локализация вертикально и горизонтально расположенных цистерн головного мозга схематически представлена на рис. 1 [3].
Публикация классификации Fisher C. M. вызвала множество споров относительно ее эффективности и ограничений [7, 14, 15, 19, 21]. К недостаткам данной классификации относят низкий коэффициент согласия наблюдателей (interobserver reliability), отсутствие верификации выраженности внутрижелудочкового кровоизлияния, низкую предиктивную способность шкалы к развитию как ангиографического, так и симптоматического ангиоспазма [9]. К сожалению, оригинальная шкала C.M. Fisher и соавт. двусмысленная по отношению к пациентам с сочетанием внутрижелудочкового и/или внутримозгового кровоизлияний и массивного базального САК. В данном случае возникает вопрос: следует ли относить эти случаи к 3 типу, подчеркивая выраженность базального САК, или к 4 типу, делая акцент на наличии крови в желудочках и/или паренхиме мозга [9]. В статье Fisher C.M. и соавт., опубликованной в 1980 г., в анализируемой группе из 47 пациентов 51 % классифицировали как 3 тип по Fisher [11]. В исследовании Frontera J.A. и соавт. (2006), включившем результаты обследования 1355 пациентов, 3 тип по Fisher установили в 67 % [14]; а в статье Wilson D.A. с соавт., опубликованной в 2012 г. (серия из 218 пациентов), — в 83,5 % случаев [26]; Nora F. Dengler с соавт. по результатам обследования 206 пациентов в 86,9 % случаев установили 3 тип по Fisher [9]. Таким образом, высокая частота распространенности 3 типа по классификации Fisher в случайной выборке пациентов с САК может негативного влиять на статистический анализ.
Поэтому сразу после опубликования классификации Fisher C.M. и соавт. начались попытки создания новых шкал в надежде создать универсальную, высокочувствительную, удобную для применения классификацию для прогнозирования развития симптоматического ангиоспазма [7, 9, 14, 15, 19, 23, 25, 26].
В 1988 г. Hijdra А. и соавт. на основании проведенного проспективного исследования и оценки данных КТ у 176 пациентов, выполненных в первые трое суток после разрыва аневризмы, предложили систему оценки заполнения кровью субарахноидальных пространств. Авторы производили измерение сгустков в 10 наиболее значимых субарахноидальных цистернах (рис. 2, 3) [16].

Рис. 1. Схематическое изображение основных базальных цистерн. Зеленым цветом обозначены вертикально ориентированные цистерны: фронтальная межполушарная цистерна (1), островковые цистерны (2), охватывающие цистерны (3); синим цветом обозначены горизонтально ориентированные цистерны: основания цистерн боковой щели (4), межножковая цистерна (5), четверохолмная цистерна (6), базальные отделы межполушарной щели (7)
Авторы предприняли попытку решить три основные задачи:
1) при оценке компьютерных томограмм учесть весь объем крови в субарахноидальных цистернах;
2) учесть наличие крови в субарахноидальных пространствах независимо от ее распространения в желудочковую систему или паренхиму головного мозга;
3) проверить оценочную шкалу на межисследовательский коэффициент согласия.
Используя поэтапный логистический регрессионный анализ, исследователи определили наиболее важные факторы риска развития церебральной ишемии вследствие ангиоспазма: объем крови в субарахноидальных цистернах по данным КТ головного мозга, выполненной не позже 72 часов после первичного разрыва аневризмы, а также объем внутрижелудочкового кровоизлияния. Авторы предположили, что внутрижелудочковое кровоизлияние может опосредованно влиять на развитие отсроченной церебральной ишемии из-за расширения желудочков и снижения перфузии ткани головного мозга и, как следствие, приводить к ишемии головного мозга. Другой потенциальной причиной может являться гипонатриемия и уменьшение количества крови в интерстициальном пространстве.
Однако классификация Hijdra A. оказалась громоздкой для применения в ежедневной практике [10, 20].
Крылов В.В. и соавт. (2015), используя шкалу Hijdra A. для количественного описания выраженности кровоизлияния у больных с массивным базальным САК, нашли ее весьма удобной для разделения пациентов с кровоизлиянием III типа по Fisher на группы и получения статистической корреляции между интенсивностью САК и возникновением ЦА [4].
Через два года после опубликования классификации Hijdra A., Sano H. и соавт. предложили свою систему оценки расположения, объема и плотности крови в базальных цистернах (табл. 3) [23].

В зависимости от интенсивности кровоизлияния продолжительность лизиса крови в субарахноидальных пространствах может различаться. Так, при 1+ и 2+ степенях САК сгустки крови по данным КТ головного мозга в течение 4 дней могут уже не определяться, а при 3+ и 4+ степенях состояние крови на КТ может оставаться неизменным в течение 7 дней [23].
В 2000 г. Qureshi A.I. и соавт. провели проспективное исследование в 54 нейрохирургических центрах Северной Америки, изучив течение заболевания и частоту ЦА у 283 пациентов с аневризматическим САК, и не обнаружили связи между наличием крови в желудочках и развитием симптоматического ангиоспазма [25]. Другие исследования показывают прямую корреляцию между внутрижелудочковым кровоизлиянием и развитием церебрального ангиоспазма [7, 14, 22].
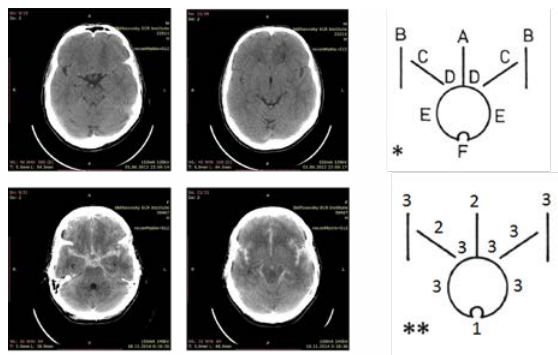
Рис. 2. Пример использования классификации Hijdra A. и соавт. (1990). Верхний ряд: аксиальные КТ и диаграмма* десяти основных базальных цистерн: фронтальная межполушарная цистерна (А), латеральные отделы сильвиевых щелей (В), срединные отделы сильвиевых щелей (С), супраселлярные цистерны (D), охватывающие цистерны (E), четверохолмная цистерна (F). Нижний ряд: аксиальные КТ и диаграмма**, указывающие количество крови в каждой цистерне по количеству баллов (от 0 до 3), где 0 — нет крови; 1 — небольшое количество крови; 2 — больше половины цистерны заполнено кровью; 3 — цистерна полностью заполнена кровью
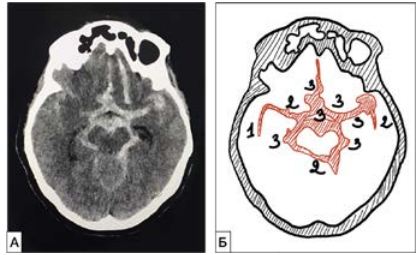
Рис. 3. Исследование пациента через 24 ч после субарахноидального кровоизлияния: А — КТ, массивное базальное субарахноидальное кровоизлияние, кровь во всех базальных цистернах, с наибольшей плотностью 74HU, Fisher III; Б — схематическое представление количественной оценки выраженности субарахноидального кровоизлияния, Hj-25 [3]
В 2001 г. Claassen J. и соавт. проанализировали результаты КТ головного мозга у 276 пациентов с нетравматическим САК. Компьютерную томографию выполняли в течение 72 часов после разрыва аневризм. Установлено, что наиболее неблагоприятным видом кровоизлияния для возникновения ЦА и ишемии головного мозга было полное заполнение одной и более цистерн кровью. Среди всех вариантов кровоизлияний с распространением в желудочковую систему мозга двустороннее заполнение кровью желудочков являлось наиболее достоверным прогностическим фактором возникновения отсроченной ишемии головного мозга. В связи с полученными данными была предложена новая классификация, основанная на прогнозировании развития симптоматического ЦА в зависимости от степени заполнения кровью не только субарахноидальных пространств, но и желудочков головного мозга [7].
По мнению Woertgen C. и соавт. (2003), за исключением второй степени, шкала Claassen J. и соавт. объективно отражает частоту развития ишемических инсультов у пациентов с разрывом аневризм. Woertgen C. с соавт. проанализировали результаты КТ исследования у 292 пациентов с аневризматическим САК, среди которых было больше пациентов со степенью 0 и 4 и меньше со степенью 1, чем в работе Claassen J. и соавт. Авторы наблюдали рост частоты развития ишемических поражений мозга при кровоизлиянии начиная от 0 и до 4 степени по данным КТ [27].
Подход, использованный Jonathan Friedman с соавт. в 2002 г., также представляет научный интерес. Авторы выбрали группу пациентов с кровоизлияниями III типа по классификации Fisher C.M. с соавт. и при помощи компьютерной программы измерили объем крови в базальных субарахноидальных цистернах. У пациентов с выраженной отсроченной ишемией головного мозга выявляли больший объем крови в субарахноидальных цистернах (медиана 30,5 см3), чем у пациентов с легкой степенью симптоматического ЦА (медиана 12,4 см3) и у пациентов без симптоматического ЦА (медиана 10,3 см3). Объем крови в желудочках и паренхиме головного мозга не влиял на вероятность возникновения симптоматического ЦА. У пациентов с кровоизлиянием III степени по Fisher C.M. и соавт. объем крови, излившейся в субарахноидальные пространства, может варьировать от 2,27 до 75,69 мл [13].

Примечание: *выраженное САК — полная тампонада кровью 1 и более цистерн.
В 2006 г. Klimo P. и Shmidt R.H. предложили ввести дополнительную градацию «Fisher III + IV» при сочетании массивного базального САК с внутрижелудочковым или паренхиматозным кровоизлиянием более 5 мл. Риск развития ангиоспазма у таких пациентов оказался выше на 28% по сравнению с пациентами, у которых было диагностировано кровоизлияние III степени по Fisher C.M. и соавт. [19].
Достоверно оценивая риск развития ангиоспазма по данным КТ, классификация Fisher С.М. и соавт. не способна прогнозировать дальнейшую эволюцию спазма, развитие ишемии, ее локализацию и объем, которые оказывают влияние на прогноз исхода заболевания.
Из современных классификаций, которые получили распространение в неврологических и нейрохирургических клиниках Северной Америки, применяется классификация Barrow Neurological Institute (BNI). Ее предложили в 2012 г. Wilson D.A. и соавт. BNI — простая и полуколичественная КТ шкала для прогноза развития симптоматического ангиоспазма. Шкала включает 5 степеней, каждой из которых соответствует определенная толщина сгустка крови, измеренная перпендикулярно цистерне или щели, в которой этот сгусток расположен [26].
Согласно шкале BNI увеличение толщины сгустка крови коррелирует с увеличением риска развития симптоматического ангиоспазма. В основу классификации BNI положен принцип, который применил Fisher C.M. и соавт., однако, по мнению авторов, преимуществом шкалы BNI по сравнению со шкалой Fisher C.M. и соавт. является более равномерное распределение пациентов по группам. В данном исследовании 84 % от всех случаев были расценены как Fisher 3. При использовании шкалы BNI ни в одной из групп процент пациентов не превышал 50. Кроме того, авторы отмечают высокую точность и соответствие выставленных заключений у разных операторов по сравнению со шкалой Fisher С.М. и соавт., которая, по их мнению, субъективна.
В 2017 г. вышло исследование Dengler N.F. и соавт. (n = 260), целью которого было выявление возможности шкалы BNI прогнозировать риск возникновения ишемического инсульта и оценивать клинический исход. По результатам исследования авторы пришли к выводу, что шкала BNI способна прогнозировать развитие ишемического инсульта и неблагоприятный клинический исход. Отмечено, что шкала BNI проста в использовании, но в то же время при ее использовании теряется важная информация о наличии внутрижелудочкового или внутримозгового кровоизлияния, что, в свою очередь, ограничивает способность данной шкалы прогнозировать исход [9].

Примечание: *толщина сгустка крови измеряется на КТ перпендикулярно расположению цистерны или щели.
Заключение
Таким образом, самой используемой классификацией прогнозирования церебрального ангиоспазма остается шкала, разработанная Fisher C.M. и соавт. Данная шкала имеет ряд недостатков (отсутствие анализа интенсивности внутрижелудочкого кровоизлияния, большая разница в интерпретации шкалы специалистами, отсутствие оценки объема крови в субарахноидальных пространствах по данным КТ и др.), многие исследователи пытались отойти от классификации Fisher C.M. с соавт. и создать более совершенную модель. Множество шкал, разработанных в последующем, указывают на отсутствие универсальной классификации, соответствующей всем современным требованиям исследователей. Использование одних шкал не позволяет прогнозировать риск развития церебрального ангиоспазма, другие — громоздкие в повседневном использовании, у третьих — низкий межисследовательский индекс, четвертые — не распространены и используются локально, в месте их разработки.
Вероятно, существует необходимость дальнейшего поиска и разработки подходящей предиктивной шкалы, возможно, с использованием искусственного интеллекта, включающей не только данные КТ головного мозга, но и другие факторы риска развития церебрального ангиоспазма.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
CONFLICT OF INTEREST
The authors declare no conflict of interest.


