Список сокращений
БМЭЦ — базальное менингоэнцефалоцеле
НЛ — назальная ликворея
КТ — компьютерная томография
КТЦГ — компьютерная цистернография
МРТ — магнитно-резонансная томография
ВЛ — васкуляризированный лоскут
Введение
Базальные менингоэнцефалоцеле (черепно-мозговая грыжа) — редкая патология, проявляющаяся пролабированием измененных оболочек и тканей головного мозга через костный дефект основания черепа. По этиологии они могут быть врожденные и приобретенные в результате травмы или хирургического вмешательства [1]. По данным разных авторов, частота врожденных менингоэнцефалоцеле составляет от 1 на 6–35 тыс. новорожденных. По частоте встречаемости приобретенных менингоэнцефалоцеле нет точных сведений [2, 3].
При лечении пациентов с данной патологией широко используется эндоскопическая техника, позволяющая устранить менингоэнцефалоцеле без внешних разрезов и косметических дефектов с минимумом кровопотери [4]. С другой стороны, при использовании эндоскопического доступа существуют высокие риски послеоперационной ликвореи и рецидивов грыжи, что связано с ограничениями возможности пластики основания черепа [5].
В 2006 г. G. Hadad и соавт. разработали методику использования назосептального лоскута на питающей ножке для пластики дефектов основания черепа. Сообщалось, что эффективность его применения выше, чем при пластике свободными трансплантатами (фрагменты широкой фасции бедра, жировой клетчатки, хряща из перегородки носа и т. д.) [6]. Также было предложено несколько других типов трансплантатов (перикраниальных, нёбных), а также разработана методика формирования лоскутов из нижних и средних носовых раковин [7]. Использование васкуляризированных лоскутов для пластики посттравматических дефектов после удаления опухолей основания черепа привело к снижению риска ликвореи в послеоперационном периоде и минимизации осложнений [8].
Васкуляризированные лоскуты являются методом выбора для пластики дефектов после трансназального эндоскопического удаления новообразований хиазмально-селлярной области у взрослых [9]. В педиатрической практике использование васкуляризированных лоскутов остается спорным вопросом, так как нет достаточных данных о возможности их использования без нежелательных последствий в виде повреждений зон роста перегородки носа и других структур лицевого скелета [10]. В основном в литературе встречаются описания единичных случаев или небольшие серии, в которых сообщалось об успешном применении лоскутов у детей для пластики дефектов основания черепа и отсутствии осложнений в послеоперационном периоде [11, 12].
Таким образом, целью нашей работы являлась оценка эффективности и безопасности применения васкуляризированных лоскутов при устранении менингоэнцефалоцеле, а также уточнение показаний к их применению в педиатрической практике.
Материал и методы
Проведен ретроспективный анализ серии пациентов в возрасте от 0 до 18 лет с базальными менингоэнцефалоцеле, проходивших хирургическое лечение в ФГАУ НМИЦН имени Н.Н. Бурденко в период с 2008 по 2020 г.
Было выделено две группы:
• пациенты, которым после устранения БЭНЦ пластика основания черепа проводилась с пользованием свободных (неваскуляризированных) трансплантатов (группа 1);
• пациенты, у которых были применены васкуляризированные лоскуты (группа 2).
Всем пациентам диагноз был поставлен на основании клинических данных, подтвержденных результатами КТ, МРТ или КТЦГ.
При формировании групп использовался метод псевдорандомизации. Пациенты были отобраны таким образом, чтобы не было статистической разницы по возрасту, полу, весу, этиологии менингоэнцефалоцеле, клиническим симптомам, уровню гемоглобина и количеству эритроцитов до операции (табл. 1).
Все пациенты были прооперированы с использованием эндоскопического доступа. Использовалась эндоскопическая стойка фирмы «Карл Шторц», (Германия), включающая в себя монитор, HD-видеокамеру, галогеновый источник света. Применялась эндоскопическая оптика, состоящая из ригидных 4 мм эндоскопов с различными углами зрения — 0°, 30°, 45°, моно- и биполярная коагуляция, стандартные эндоскопические инструменты и инструменты, изогнутые под различными углами.
Первым этапом во время операции проводилось выделение из окружающих тканей и удаление менингоцеле с помощью монополярной коагуляции или микроножниц. Вторым этапом осуществлялось обнажение костных краев дефекта основания черепа. Далее выполнялась многослойная пластика с использованием различных видов трансплантатов.
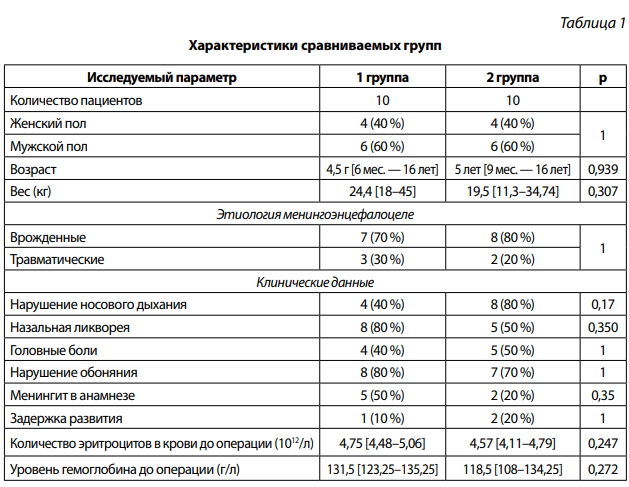
В случае использования свободных (неваскуляризированных) лоскутов (группа 1) использовались аутотрансплантаты: фрагменты широкой фасции бедра, фрагменты жировой клетчатки, фрагменты кости, хряща перегородки носа и гемостатический материал — Тахокомб. При этом сначала устанавливали пластический материал интракраниально, затем снаружи от дефекта с его значительным перекрытием фиксировали второй трансплантат (рис. 1).
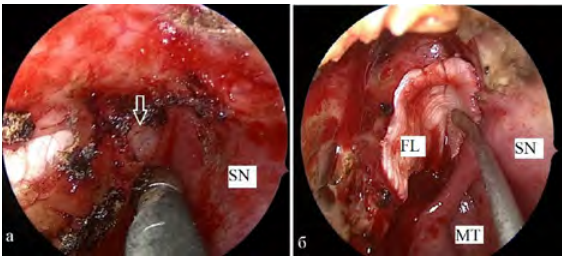
Рис. 1. Фото операционной раны: осмотр полости носа через эндоскоп справа (0 °): а) дефект основания черепа в области крыши решетчатого лабиринта справа (указан стрелкой); б) широкая фасция бедра (FL) расположена в области дефекта крыши решетчатого лабиринта справа. SN — перегородка носа, MT — средняя носовая раковина
Забор фрагмента широкой фасции бедра проводился по стандартной методике из горизонтального разреза длиной 3–5 см на наружной поверхности верхней трети бедра.
При использовании васкуляризированных лоскутов (группа 2) интракраниально, как правило, устанавливали пластины Тахокомба, затем со стороны полости носа укладывали перемещенный лоскут на питающей ножке.
Использовалось несколько вариантов васкуляризированных лоскутов:
1. Назосептальный (n = 6) — для его формирования проводилось два горизонтальных разреза слизистой носовой перегородки на стороне дефекта. Верхний разрез располагался на 1–2 см ниже от уровня верхней носовой раковины, чтобы сохранить обонятельный эпителий, располагающийся выше. Спереди оба разреза соединялись вертикальным разрезом. Далее проводилась отслойка лоскута от перегородки носа с помощью распатора. Затем лоскут ротировали и укладывали на область дефекта. Кровоснабжение обеспечивалось ветвями задней перегородочной и клино-нёбной артерией (рис. 1). Лоскут использовался при дефектах ситовидной пластинки и клиновидной пазухи (рис. 2).
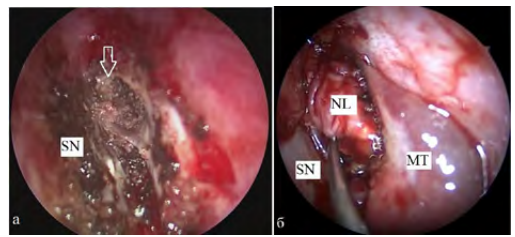
Рис. 2. Фото операционной раны: осмотр полости носа через эндоскоп слева (0 °): а) дефект основания черепа в области ситовидной пластинки слева (указан стрелкой); б) назосептальный лоскут (NL), расположенный в области ситовидной пластинки после удаление менингоэнцефалоцеле слева. SN — перегородка носа, MT — средняя носовая раковина
2. Ротированная средняя носовая раковина (n = 4) — проводили частичное рассечение хрящевого основания средней носовой раковины и перемещение ее в область дефекта. Кровоснабжение лоскута сохранялось за счет передней решетчатой артерии. Метод применялся при дефектах в области крыши решетчатого лабиринта, ситовидной пластинки (рис. 3).
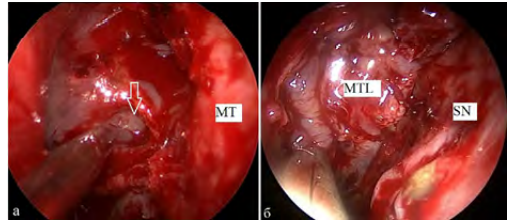
Рис. 3. Фото операционной раны: осмотр полости носа через эндоскоп справа (0 °): а) дефект основания черепа в области крыши решетчатого лабиринта после удаления менингоэнцефалоцеле справа (указан стрелкой); б) ротированная средняя носовая раковина (MTL), расположенная в области дефекта. SN — носовая перегородка, MT — средняя носовая раковина
Для определения безопасности проведено сравнение по частоте интраоперационных осложнений, величине кровопотери, а также количеству эритроцитов, структура жалоб в послеоперационном периоде. Для определения эффективности исследуемые группы сравнивали по частоте развития назальной ликвореи, рецидива менингоцеле, воспалительных осложнений (менингит, абсцесс головного мозга) в послеоперационном периоде.
Статистический анализ
Статистический анализ проводили с использованием точного критерия Фишера и анализа произвольных таблиц сопряженности с использованием критерия χ2. Проведен анализ литературных источников в целях сравнения полученных нами данных с результатами других исследований.
Результаты
Результаты статистического анализа сравниваемых групп приведены в табл. 2.
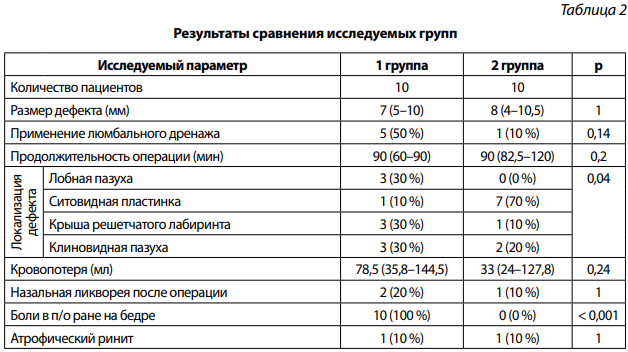
Как видно из таблицы, не было установлено статистически значимой разницы в группах по размеру дефекта и частоте применения люмбального дренажа.
Также необходимо отметить, что продолжительность операции в группе, где использовали назосептальной лоскут, не выше, чем в группе, где применялась широкая фасция бедра. Не выявлено достоверных различий по объему кровопотери в группах.
Установлена статистически значимая разница в группах по локализации дефекта (p = 0,048). Васкуляризированные лоскуты не применялись при дефектах лобной пазухи. Однако в большинстве наблюдений — 7 (70 %) васкуляризированные лоскуты применялись при дефектах ситовидной пластинки. Свободные трансплантаты применялись для пластики дефекта любой локализации.
В первой группе пластика дефекта основания черепа после устранения БМЭЦ была эффективна в 8 наблюдениях (80 %) при первичных операциях. В 2 наблюдениях (20 %) отмечалась послеоперационная НЛ. Во второй группе пластика дефектов основания черепа была эффективна в 9 наблюдениях (90 %). Рецидив возник у одного (10 %) пациента. Статистический анализ не показал значимой разницы между группами по рецидивам в послеоперационном периоде (p = 1).
Отмечена статистически значимая разница в группах по жалобам в раннем послеоперационном периоде (p < 0,001). Все 10 пациентов (100 %) из первой группы сообщили о боли в области послеоперационной раны на бедре, чего не было во второй группе.
Приведем примеры пациентов, у которых выполнялась повторная операция по поводу возникновения назальной ликвореи.
Клиническое наблюдение 1
Пациент Н., 5 лет, был направлен в Центр в связи с назальной ликвореей. Из анамнеза известно, что три месяца назад перенес черепно-мозговую травму в результате ДТП. Отмечались ушиб головного мозга тяжелой степени с формированием контузионно-геморрагического очага 2 типа лобной доли, субарахноидального кровоизлияния, множественных дефектов в области лобной пазухи, крыши решетчатого лабиринта слева. По данным КТЦГ выявлялось менингоцеле клеток решетчатого лабиринта, признаки истечения ликвора из дефекта в крыше решетчатого лабиринта (рис. 4).
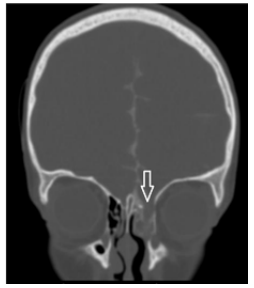
Рис. 4. КТЦГ фронтальная проекция, менингоцеле клеток решетчатого лабиринта слева. Стрелкой указан дефект в области крыши решетчатого лабиринта
Ход лечения: выполнено эндоскопическое удаление менингоэнцефалоцеле с пластикой дефекта передних отделов крыши решетчатого лабиринта. Во время операции в качестве пластического материала применяли фрагмент широкой фасции бедра. Послеоперационный период протекал удовлетворительно, однако спустя месяц после операции НЛ возобновилась. Пациенту повторно выполнена многослойная пластика дефектов крыши решетчатого лабиринта и лобной пазухи с использованием широкой фасции бедра и Тахокомба. При повторном осмотре через год рецидивов не отмечалось.
Клиническое наблюдение 2
Пациентка Н., 6 лет, обратилась в Центр нейрохирургии с жалобами на периодические жидкие выделения из левой половины носа, нарушения обоняния, головные боли. По данным анамнеза в 5 лет получила травму в результате ДТП. Лечилась по месту жительства с диагнозом: сочетанная автодорожная травма: тяжелая лобно-лицевая травма. Ушиб головного мозга тяжелой степени. Паренхиматозно-субарахноидальное кровоизлияние. Вдавленный перелом лобной кости с переходом линии перелома на верхнеглазничные края орбит, корень носа, чешую височной кости справа, на переднюю черепную ямку. Перелом верхней челюсти справа. Гематосинус справа. По месту жительства проведена операция: декомпрессионная трепанация с удаление вдавленных отломков лобной кости. Спустя месяц пациентка выписана в удовлетворительном состоянии под амбулаторное наблюдение педиатра и невролога. Вскоре отметили появление жидких выделений из полости носа слева. Выполнено КТ, МРТ, на которых выявлено трансэтмоидальное менингоцеле, дефект основания черепа в области крыши решетчатого лабиринта слева (рис. 5).
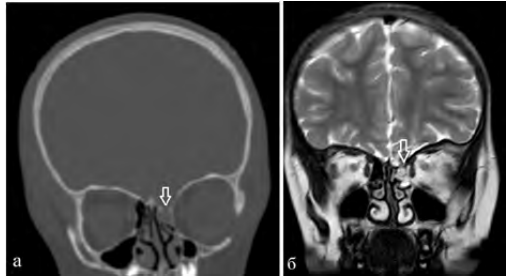
Рис. 5: а — КТ, б — МРТ, фронтальная проекция, менингоцеле клеток решетчатого лабиринта слева. Стрелкой отмечен дефект крыши решетчатого лабиринта
Ход лечения. В связи с высоким риском развития менингита из-за наличия рецидивирующей назальной ликвореи было принято решение первым этапом устранить менингоэнцефалоцеле и выполнить пластику дефекта крыши решетчатого лабиринта эндоскопическим доступом. Вторым этапом планировалась краниопластика. Во время операции было удалено менингоцеле, визуализирован крупный дефект. Интракраниально установили пластины Тахокомба, со стороны полости носа поверх дефекта уложен лоскут, сформированный из носовой раковины. Послеоперационный период протекал без осложнений, пациентка была выписана на 5-е сутки после операции.
Спустя 6 месяцев у пациентки на фоне ОРЗ и сильного кашля появилась менингиальная симптоматика, возникли симптомы назальной ликвореи. После проведенного лечения по поводу менингита пациентке выполнили повторную пластику транскраниальным доступом с одномоментной краниопластикой. Во время операции в качестве пластических материалов для закрытия дефекта основания черепа использовали васкуляризированный надкостничный лоскут, пластины Тахокомба.
Таким образом, причиной возникновения назальной ликвореи в первом случае являлось отторжение трансплантата спустя месяц после пластики за счет субатрофических посттравматических изменений в полости носа. Во втором случае провоцирующими факторами являлся сильный кашель, а также развившийся менингит, который привел к лизису рубца в зоне фистулы.
Дискуссия
Менингоэнцефалоцеле основания черепа — это редкое заболевание, которое может привести к тяжелым воспалительным осложнениям, таким как менингит, менингоэнцефалит, абсцесс головного мозга. Лечение БМЭЦ хирургическое, которое заключается в иссечении грыжевого мешка с герметичным закрытием дефекта [13].
По данным литературных источников, наиболее эффективно использование многослойной пластики с размещением трансплантатов интракраниально и экстракраниально со стороны полости носа [14–16]. Существует описание различных видов трансплантатов, среди которых выделяют свободные аутотрансплантаты (фрагменты широкой фасции бедра, жировой клетчатки, кости, хряща), гемостатический материал (Тахокомб) и васкуляризированные лоскуты (назосептальный лоскут, лоскут из носовой раковины) [17]. Однако нет четкого алгоритма для выбора трансплантата при лечении менингоэнцефалоцеле основания черепа у детей.
Известно, что риск возникновения назальной ликвореи в послеоперационном периоде при использовании свободных трансплантатов выше, чем при использовании васкуляризированных лоскутов. По данным M. Koutourousiou и соавт., при использовании свободных трансплантатов НЛ возникала в 58,8 % наблюдений, а при применении васкуляризированных назосептальных лоскутов всего лишь в 10 % наблюдений [18]. A. Laibangyang и соавт. сообщают об успешном применении лоскутов для пластики дефектов основания черепа и отсутствии осложнений в послеоперационном периоде у детей [19].
С другой стороны, в литературе сообщается о риске возникновения различных осложнений, таких как деформация носа, формирование спаек, атрофический ринит [20]. Также существует мнение, что у детей формирование лоскута затруднительно в связи с небольшим размером полости носа, незавершенным развитием эндоназальных структур и околоносовых пазух [21].
Nation и соавт. анализировали эффективность различных трансплантатов для пластики дефектов основания черепа после удаления опухолей селлярной и параселлярной областей у детей. Они полагают, что при возникновении профузной назальной ликвореи интраоперационно (например, при вскрытии желудочковой системы во время удаления опухоли) необходимо применять васкуляризированные лоскуты для надежной герметизации дефекта. В случаях, когда назальная ликворея во время операции незначительная или отсутствует, возможно применение свободных трансплантатов [22]. Keshri и соавт. в своем исследовании ориентировались на размеры дефекта. При дефектах более 5 мм они рекомендовали использовать васкуляризированные лоскуты [23].
В нашей работе проводился анализ собственного опыта использования васкуляризированных лоскутов у детей. Серия охватывает 10-лений опыт работы начиная с 2010 г. и включает то время, когда мы осваивали методику. Не получено статистически значимых различий между группами по размеру дефекта и частоте использования люмбального дренажа.
Помимо характеристик дефекта, некоторые авторы в выборе трансплантата опирались на данные о локализации дефекта. Гайдуков С. С. и соавт. приводили алгоритм выбора васкуляризированного транплантата при пластике дефектов у взрослых пациентов с назальной ликвореей. При расположении дефекта в области ситовидной пластинки или клиновидной пазухе авторы рекомендовали применение назосептального лоскута, при расположении фистулы в области крыши решетчатого лабиринта — лоскута из средней носовой раковины [24]. Мы придерживались похожего алгоритма в зависимости от расположения дефекта. Васкуляризированные лоскуты не применялись при дефектах лобной пазухи, так как его длины может не хватить, а также высок риск обструкции носолобного кармана при его использовании.
Анализ полученных данных показал, что группы сопоставимы по времени проведения операции и анестезиологического пособия. Кровопотеря во время операции, уровень гемоглобина и количество эритроцитов после операции в группах не имели достоверных различий. Это подчеркивает, что использование васкуляризированных лоскутов не удлиняет время вмешательства, не обладает большей травматичностью. С другой стороны, в первой группе у всех пациентов отмечались жалобы на боли в послеоперационной ране на бедре (p < 0,001), в двух случаях отмечалось развитие послеоперационной гематомы в послеоперационной области на бедре, чего не отмечалось во второй группе. Не выявлено различий по явлению послеоперационного ринита. Nougueira и соавт. сообщают, что в детском возрасте выполнять санацию с помощью электроотсоса детям затруднительно в связи с беспокойством ребенка. Недостаточный уход за полостью носа может привести к образованию атрофического ринита и спаек, особенно у пациентов с большой раневой поверхностью, образовавшейся после забора лоскута [25]. По мнению London Jr., у пациентов младше 6 лет развитие местного воспаления и несостоятельность пластики может встречаться чаще в связи с неадекватным уходом за полостью носа в послеоперационном периоде. Для решения этих проблем они предлагают использовать седацию в послеоперационном периоде для выполнения санирующих манипуляций, чтобы избежать сильного плача и натуживания у детей [26].
В литературе сообщается о негативном воздействии на зоны роста перегородки и черепно-лицевого скелета при заборе трансплантата [27]. Тем не менее Shah и соавт. исследовали возможность применения назосептального лоскута у 4 младенцев. Они сообщили об отсутствии негативного эффекта на рост перегородки и черепно-лицевую область при наблюдении детей в течение 23 месяцев после операции, поскольку производили забор лоскута только с одной стороны и не травмировали костно-хрящевые структуры перегородки носа [28]. В нашей серии случаев также не было отмечено подобных осложнений. Однако не было проведено долгосрочного наблюдения и не проводился осмотр этих пациентов в подростковом возрасте, когда происходит интенсивный рост структур перегородки носа.
По нашим данным, при использовании васкуляризированных лоскутов процент послеоперационной ликвореи был в два раза меньше, чем при использовании свободных трансплантатов (10 и 20 % соответственно), но эти различия статистически не значимы из-за малой выборки пациентов. Chivukula и соавт. сообщили, что с началом использования назосептального лоскута для пластики дефектов основания черепа после эндоскопического удаления опухолей риск развития послеоперационной назальной ликвореи снизился с 12,5 до 8,9 % [29].
Ограничением настоящего исследования является ретроспективный дизайн, небольшое количество наблюдений, а также отсутствие отдаленного катамнеза. Для получения более достоверных результатов необходимо продолжить исследование по данному вопросу.
Выводы
1. Васкуляризированные лоскуты являются эффективными для пластики дефекта основания черепа у детей при устранении менингоэнцефалоцеле.
2. Доказана безопасность использования лоскутов интраоперационно и в раннем послеоперационном периоде. Остается неизученным вопрос об отдаленных результатах и влиянии формирования васкуляризированного лоскута на структуры лицевого скелета.
3. При планировании устранения менингоэнцефалоцеле у детей и выборе пластического материала необходимо учитывать локализацию фистулы.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
CONFLICT OF INTEREST
The authors declare no conflict of interest.
Участие авторов:
Концепция и дизайн исследования — Ш. Е. В, Ч. Н. А., С. Л. А.
Сбор и обработка материала — Ч. Н. А., С. Ю. В.
Написание текста — Ч. Н. А., С. Л. А., С. А. В.
Редактирование — Ш. Е. В., Н. С. Д., К. М. А.


