Список сокращений:
АВМ — артериовенозная мальформация;
СМА — средняя мозговая артерия;
S — M — Spetzler-Martin
S — P — Spetzler- Ponce
PSM — propensity score matching
mRS — modified Rankin Scale;
NBCA — N-бутил цианоакрилат
Введение
Артериовенозные мальформации (АВМ) — врожденная сосудистая патология, клинически проявляющаяся кровоизлиянием (53 %), генерализованными (30 %) или фокальными (10 %) эпилептическими припадками, хронической головной болью (14 %), преходящим (7 %) или прогрессирующим (5 %) очаговым неврологическим дефицитом [1]. АВМ головного мозга являются причиной 1–2 % всех инсультов и 4 % всех первичных внутримозговых кровоизлияний, одна треть из которых происходит во 2–3-й декаде жизни [2]. Хирургическое лечение АВМ — наиболее радикальный метод, позволяющий одномоментно полностью исключить риск кровоизлияния из мальформации, снизить частоту эпиприступов [3, 4]. В отношении АВМ небольшого размера, поверхностной и доступной локализации микрохирургия является методом выбора. В более сложных случаях зачастую прибегают к предоперационной эмболизации [5, 6]. Сравнительный анализ результатов лечения пациентов с АВМ головного мозга с использованием различных методов предъявляет высокие требования к стандартизации пациентов с учетом морфологии мальформаций и наличия факторов, способных влиять на исход лечения. В нашей работе мы описываем основные осложнения, и проводим сравнительный анализ исходов микрохирургического лечения АВМ головного мозга с предварительной эндоваскулярной эмболизацией при помощи метода псевдорандомизации.
Методы
В ретроспективное исследование были включены 169 пациентов с артериовенозными мальформациями головного мозга проходившие лечение на базе ФГАУ НМИЦН им. акад. Н.Н. Бурденко: основную группу (56 пациентов) составили пациенты, у которых была выполнена предоперационная эмболизация АВМ, контрольную (113 пациентов) — пациенты, подвергнувшиеся только микрохирургическому лечению.
Для оценки лечебных мероприятий в основной группе были учтены количество процедур эмболизации, интервал между эмболизацией и хирургией, эмболизирующий агент. По радикальность предоперационной эмболизации АВМ были разделены на 3 группы: эмболизация >75 % АВМ, от 75 до 50 %, и <50 % мальформации. Радикальность удаленной мальформации оценивалась на основании наличия остаточной функционирующей части АВМ на контрольных ангиограммах. Описаны основные технические и неврологические осложнения эндоваскулярного и хирургического лечения, причины функциональных ухудшений и хирургическая летальность.
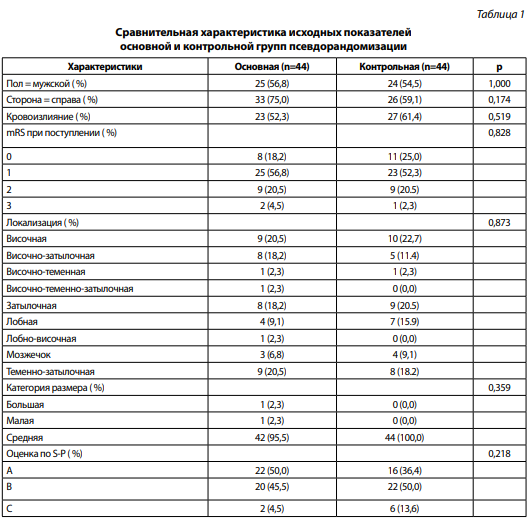
С целью увеличения статистической силы исследования при оценке функциональных исходов лечения было проведено сравнение с применением метода псевдорандомизации, или сопоставления показателей склонности (Propensity Score Matching) [7]. По ранее выбранным критериям из основной исследуемой и контрольной группы при помощи применения соответствующего алгоритма автоматически были набраны пары пациентов. Критериями сопоставления служили: пол, локализация АВМ, возраст, оценка АВМ по шкале Spetzler — Martin [8] и Spetzler — Ponce [9], оценка по модифицированной шкале Ренкина (mRS) на момент поступления в стационар, наличие кровоизлияния в анамнезе как значимого фактора, влияющего на исход лечения. Всего было подобрано 44 пары пациентов, статистически не отличающихся ни по одному из выбранных критериев и теоретически принадлежащих одной выборке. Оценивались как абсолютный, так и относительный (разница баллов) функциональный исходы лечения. Статистический анализ был выполнен с применением соответствующих критериев. Результат считался статистически значимым при p <0.05.
Результаты
Пациентам основной группы было выполнено 58 сеансов эмболизации (в двух случаях предоперационная эмболизация была выполнена дважды). В качестве эмболизирующих агентов были использованы гистоакрил 6 (10,7 %) пациентов, NBCA 32 (57,1 %) пациента, ONYX 1 (1,8 %) пациент, отделяемые платиновые микроспирали 13 (23,2 %) пациентов; а также комбинации эмболизирующих агентов: микроспирали + NBCA 3 (5,4 %) пациента, спирали + гистоакрил + ONYX 1 (1,8 %) пациент. В среднем в ходе одного эндоваскулярного вмешательства было закрыто 1,74 афферента (от 1 до 5 афферентов).
Большинству пациентов (36 (65,5 %) эндоваскулярная эмболизация и микрохирургическое иссечение АВМ было произведено в течение одних суток. Средний интервал между эмболизацией и хирургией составил 1,84 дня (0–19 дней).
В 21 (37,5%) случае артериовенозные мальформации были эмболизированы тотально или субтотально, в 10 (17,9 %) случаях — выявлена деваскуляризация 50–75 % АВМ, в 25 (44,6 %) случаях мальформации были выключены на 50 % и менее от исходного объема. В последнюю группу вошли случаи целенаправленной деваскуляризации отдельных крупных труднодоступных афферентов АВМ, закрытия фистульных компонентов и гемодинамических аневризм с несущими сосудами при помощи микроспиралей и/или жидких эмболизирующих агентов (рис. 36).
Выявлены симптомные и бессимптомные осложнения. Бессимптомные (технические осложнения: приклеивание кончика микрокатетера (NBCA) — 1 (1,7 %) случай; наличие в системе дренирующих вен мальформации клеевых композиций (ONYX, NBCA, гистоакрила) — 4 (6,9 %); экстравазация эмболизирующих агентов (витков микроспиралей из стенки афферента и небольшого количества масс гистоакрила у одной из стенок узла АВМ) — 2 (3,4 %) случая; рентгенологически подтвержденный эмболизм мелких ветвей легочной артерии клеевой композицией NBCA — 1 (1,7 %) случай. Симптомные осложнения: кровоизлияние из АВМ (в первом случае — спустя 1 час, во втором — на вторые сутки после эндоваскулярной эмболизации) — 2 (3,4 %) случая; ишемия в области подкорковых ядер из-за заполнение клеем транзитных ветвей из бассейна правой СМА 1 (1,7 %) случай. После удаления АВМ и внутримозговых гематом пациенты имели удовлетворительный функциональный статус (mRS=2). В ходе предоперационной эмболизации в 2 (3,4 %) случаях произошли фатальные осложнения из-за миграции клеевых композиций в дренажную вену с окклюзией синусов, в одном приведшее к массивному кровоизлиянию, а в другом — обширному венозному инфаркту.
В основной исследуемой группе было проведено 57 хирургических вмешательств по удалению АВМ головного мозга. В ходе вмешательств, по данным протоколов операции, зафиксировано 8 (14,5%) эпизодов интраоперационного кровотечения из компартментов АВМ разной степени выраженности (3 — из культи не полностью эмболизированного афферента; 3 — диффузные компоненты АВМ: сосудистые сплетения боковых желудочков головного мозга или зоны ангиоматоза; 2 — кровотечение из стромы АВМ в результате ее разрыва). В 2 (3,5 %) случаях произошел эпизод интраоперационной воздушной эмболии. Радикальность иссечения АВМ в основной исследуемой группе составила 98,2 %. Радикальность удаления мальформаций в контрольной группе (без предварительной эмболизации) составила 95,6 %.
В структуре неврологических исходов по модифицированной шкале Ренкина в экспериментальной группе преобладали случаи, когда функциональный статус пациента остался неизменным (21 (38,2 %) случай) или ухудшился на 1 балл (19 (34,5 %) случаев). Наиболее частой причиной снижения оценки функционального статуса было появление или усугубление зрительных нарушений (частичной или полной гомонимной гемианопсии) — 17 (50 %) пациентов. Вторым по частоте последствием, которые грубее снижали функциональный статус пациентов, стали речевые нарушения (моторная и акустико-мнестическая афазия) — 4 (11,8 %) пациентов, нарастание мозжечковой симптоматики — 3 (8,8 %) пациентов, развитие астенического синдрома и когнитивных нарушений в результате поражения лобных долей у 3 (8,8 %) пациентов. Еще у 2 (5,9 %) пациентов усугубился эписиндром. В 1 (2,9 %) случае развилась грубая неврологическая симптоматика в виде спастического тетрапареза.
У 3 пациентов в экспериментальной группе произошло улучшение функционального статуса к моменту выписки. Причинами стали регресс пирамидной симптоматики и зрительных нарушений.
Суммарная летальность микрохирургического иссечения АВМ головного мозга с предварительной эндоваскулярной эмболизацией составила 3,6 % (2 случая). В обоих случаях неблагоприятный исход был обусловлен эмболическими (ишемическими) осложнениями эндоваскулярной эмболизации.
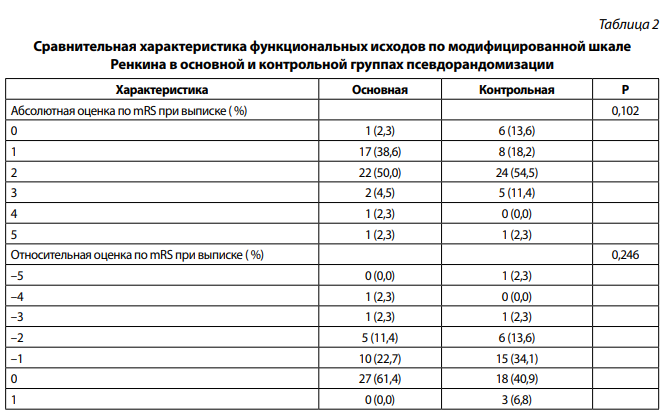
В результате сравнения функциональных исходов в парах, набранных методом псевдорандомизации, было установлено, что результаты группы пациентов, где была проведена предоперационная эндоваскулярная эмболизация, не отличались от пациентов контрольной группы ни в абсолютном, ни в относительном отношении (табл. 2).
Обсуждение
Сравнительный анализ результатов лечения пациентов с АВМ головного мозга с использованием различных методов предъявляет высокие требования к стандартизации пациентов. Для подбора контрольной группы требуется наличие большого пула пациентов, что доступно только крупным специализированным центрам. В этом отношении интересны работы с использованием метода псевдорандомизации, который успешно применяется в небольших выборках. К сожалению, найденные нами работы с применением этой методики были посвящены только радиохирургическому лечению АВМ головного мозга в сочетании с другими методами [10, 11]. Использованные нами в исследовании общепринятые критерии стандартизации, такие как шкалы S-M и S-P хорошо зарекомендовали себя для оценки риска исходов микрохирургии. Однако в отношении эндоваскулярной эмболизации или комбинации последней с микрохирургией их ценность неоднозначна. Решение о проведении предоперационной эмболизации принималось в основном исходя из морфологии АВМ, ее размеров, локализации, количества афферентов, количества питающих артериальных бассейнов, наличия фистульных компоненов и гемодинамических аневризм — большинство этих факторов не учитывается классическими шкалами.
Статьи, посвященные анализу результатов заглавного метода лечения, немногочисленны в зарубежной и отечественной литературе. В большинстве исследований авторы единодушны в том, что предоперационная эмболизация оказывает положительный эффект на результаты хирургии АВМ головного мозга [12–18]. В то же время в метаанализе M.K. Morgan с соавт. приходят к выводу, что предоперационная эмболизация АВМ при помощи NBCA не улучшает результаты микрохирургического лечения. На наш взгляд, одной из причин разночтений могут являться различия в методологии исследований. L. Pierot и соавт., предпринявшие попытку оценить эффективность предхирургической эмболизации в мультицентровом рандомизированном исследовании BRAVO, столкнулись с трудностью: подходы к этой процедуре в сериях различались. Главное отличие заключалось в стратегии предоперационной эмболизации — в одних центрах ЭЭ применяли как основной метод лечения и, лишь после того, как она не достигала запланированной цели, переходили к микрохирургическому иссечению АВМ; в других ЭЭ проводилась как запланированный первый этап перед иссечением АВМ [19]
В отношении количества сеансов эмболизации и короткого интервала между эмболизацией и хирургией выбранная нами тактика находит одобрение у ряда исследователей, сообщающих о хороших результатах одноэтапной эмболизации с последующей ускоренной хирургией АВМ. В работе Starke с соавт. эмболизация АВМ в течение более чем одной сессии статистически значимо вызывала неврологический дефицит (p<0,15) [20]. Sahlein с соавт., проанализировав результаты лечения 130 пациентов с АВМ головного мозга при помощи эндоваскулярной эмболизации, делают вывод о том, что агрессивная тактика эмболизации в 1 сеанс не только не уступает, но может быть эффективнее эмболизации в несколько подходов [21]. Сокращение до минимума сроков между эндовазальной преэмболизацией и микрохирургическим удалением АВМ способствует снижению риска отсроченных геморрагических осложнений. Тем не менее нам, как и в других крупных сериях [22, 23], не удалось полностью избежать ранних геморрагических осложнений, которые в нашей серии составили 3,6%, но не привели к неблагоприятным исходам.
Анализ результатов хирургического лечения нашей серии пациентов показал, что наибольшую опасность для пациентов представляли ишемические эмбологенные осложнения. В работе Haw и соавт. осложнения эндоваскулярной эмболизации делились на 3 типа: геморрагические, ишемические и технические. В исследовании доля ишемических осложнений преобладала — 27 (8,8 %) случаев; однако геморрагические осложнения (18 (5,9%) случаев) чаще приводили к летальному исходу — 6 случаев. Техническими осложнениями были приклеивание кончика микрокатетера, перфорация стенки артерии микрокатетером и разрыв катетера с клеевой эмболией, который привел к летальному исходу. Суммарный процент стойкого неврологического дефицита и неблагоприятных исходов был равен 3,9% [22]. Taylor с соавт., проанализировав серию из 201 пациента, которым было выполнено в общей сложности 339 сеансов предоперационной эмболизации, установили, что предоперационная эмболизация приводит в 9 % случаев к постоянному неврологическому дефициту и в 2% — к смерти пациентов [23].
Анализируя результаты микрохирургии АВМ головного мозга с использованием предхирургической эмболизации, исследователь невольно сталкивается с систематической ошибкой выжившего. Из-за крайне высоких требований, предъявляемых к хирургии АВМ головного мозга на современном этапе, анализ осложнений только микрохирургических вмешательств у пациентов с крупными и сложными АВМ крайне затруднен, так как подобные операции сопряжены с высоким риском и попросту не проводятся, уступая место альтернативным методам лечения или динамическому наблюдению. Проведение же проспективных рандомизированных исследований по этическим соображениям не представляется возможным [24].
Заключение
Изучение строения, гемодинамики узла АВМ, усовершенствование средств доставки клевых композиций, а также внедрение новых эмболизирующих агентов наряду с накапливающимся опытом микрохирургических вмешательств будут способствовать улучшению результатов эндоваскулярной эмболизации, повышению ее радикальности без увеличения риска осложнений, что позволит сделать микрохирургическое удаление мальформаций еще более безопасным.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
Концепция и дизайн исследования:
А.В. Дмитриев, Ш.Ш. Элиава
Сбор и обработка материала
А.В. Дмитриев, Ш.Ш. Элиава, С.Б. Яковлев, А.С. Хейреддин, Ю.В. Пилипенко
Статистическая обработка данных
А.В. Дмитриев, Ю.В. Струнина.
Написание текста
А.В. Дмитриев
Редактирование
А.В. Дмитриев, Ш.Ш. Элиава
CONFLICT OF INTEREST
The authors declare no conflict of interest.
Research concept and design: A.V. Dmitriev, Sh.Sh. Eliava
Material collection and processing: A.V. Dmitriev, Sh.Sh. Eliava, S.B. Yakovlev, A.S. Kheyreddin, Yu.V. Pilipenko
Statistical data processing: A.V. Dmitriev, Yu.V. Strunina
Text writing: A.V. Dmitriev
Editing: A.V. Dmitriev, Sh.Sh. Eliava


