Актуальность темы
В настоящее время добавление кормовых ферментов при составлении рационов стало обыденным делом. Ферменты, направленные на разрушение некрахмалистых полисахаридов (НПС): ксиланаза, глюканаза и целлюлаза. Они по частоте использования занимают второе место в мире и первое место в России после фитазы. В то же время применяются ферменты: протеаза, маннаназа, пектиназа, амилаза, галактозидаза и др.
В связи с широким применением ферментов рынок производства кормов требует доступные, информативные и валидированные методы оценки ферментов как в товарном продукте, так в премиксах и комбикормах. Такое рутинное исследование по определению активности ферментов должно было стать существенным шагом в контроле использования ферментов, качества их производства и применения [11].
Определение активности ферментов проводится по утвержденной методике с определенным субстратом, при определенной температуре и в установленном интервале времени. Активность ферментов выражается в единицах активности, которая показывает количество фермента, необходимое для высвобождения 1 ммоля моносахарида за 1 мин (μmol×min–1) [14]. Этот показатель применим для определения качества фермента при производстве, определении стабильности при хранении, после грануляции и других агрессивных воздействиях на корм.
В системе СИ активность ферментов (как катализаторов химических реакций) выражается в каталах и понимается как количество фермента, которое катализирует превращение 1 моль субстрата за 1 с. Катал выражает особенность «размера» молекулы фермента не охваченными другими единицами. Что касается того, почему измерение количества ферментов в каталах по сравнению с молями или граммами, аргумент аналогичен тому, почему существуют отдельные единицы для массы (например, грамм) и числа (моль). Однако использование катала в прикладной энзимологии менее популярно, чем классические подходы в настоящее время. Также используется способ расчета удельной ферментативной активности, характеризующего ферментативную активность по точечному принципу (измерение до и после некоторого временного интервала).
В Российской Федерации приняты несколько государственных стандартов по определению активности ксиланазы, глюканазы, целлюлазы и амилазы. ГОСТы разработаны для разных отраслей промышленности, в частности есть ГОСТы для ксиланазы и целлюлазы для целлюлозно-бумажной и спиртовой промышленности, а также для пищевой промышленности. Также разработаны ГОСТы с участием ВГНКИ и НПО «Лекбиотех» для определения активности ферментов в животноводстве при производстве комбикормов:
– ГОСТ 31488-2012. Препараты ферментные. Методы определения ферментативной активности ксиланазы [3].
– ГОСТ 31662-2012. Препараты ферментные. Методы определения ферментативной активности целлюлазы [4].
– ГОСТ 34176-2017. Препараты ферментные. Методы определения ферментативной активности эндо-β-глюканазы [5].
Также ГОСТ 54330-2011. Ферментные препараты для пищевой промышленности. Методы определения амилолитической активности. Данный ГОСТ разработан для пищевой промышленности, но им можно пользоваться при определении активности амилазы в комбикормах [6].
Сегодня не существует единого стандартного метода для определения активности ферментов, разрушающих НПС. Каждый производитель НПС-ферментов использует собственный подход, а также собственные условия анализа (рН, температуру, субстрат и т. д.). Поэтому каждый производитель дает собственное понятие единицы активности НПС-ферментов [10].
Уровень активности ферментных препаратов является наиболее важным критерием, определяющим их жизнеспособность. Исходя из величины ферментативной активности (или соотношения разных активностей), осуществляется подбор препарата и его дозировка. Методики определения активности в разных исследовательских лабораториях, компаниях, странах существенно отличаются друг от друга [2]. В настоящее время на рынке большое количество как зарубежных, так и отечественных кормовых ферментных препаратов для разрушения НПС. Они представляют собой продукты, полученные с помощью биосинтетических процессов, осуществляемых различными микроорганизмами, которые синтезируют внеклеточные ферментные комплексы или индивидуальные ферменты. Комплексные мультиферментные препараты обусловливают универсальность их действия на различные виды НПС и рационов [1].
Наличие большого разнообразия единиц активности ферментов, которые применяют разные производители, обусловлен, прежде всего, тем, что каждому производителю удобно применять «свою» единицу активности для стандартизации своих ферментов при производстве. Очевидно, что прямым способом определения активности («активности по применению») является испытание in vivo, т. е. непосредственно при кормлении животных. Однако это не всегда возможно, особенно на стадии разработки и изготовления препарата. Поэтому в практике промышленной энзимологии при производстве и коммерциализации ферментов в качестве характеристики принято использовать значение активности, определенной in vitro – в условиях биохимической лаборатории без использования живых организмов [1].
С биотехнологической точки зрения в промышленной энзимологии практически невозможно получить моноэнзимный продукт либо осуществить высокую степень очистки от побочных активностей [2]. Возможно, в будущем различные генно-модифицированные конструкции продуцентов смогут обеспечить производство монометаболитов, которые будут обеспечивать максимальную чистоту кормовых моноферментных препаратов.
Проблемы для потребителя заключаются в сложности ориентирования в этом многообразии предлагаемых рынком препаратов и часто в невозможности их сравнения. Производители указывают специфические активности ферментов, как правило, руководствуясь своими понятиями о единицах активности и методах их определения. Предлагаемые спецификациями методики анализа включают дорогостоящие субстраты и стандартные образцы, при этом субстраты в разных методиках могут различаться, а стандарты имеют заявляемые активности, получаемые по неизвестным методикам. В результате предлагаемый достаточно дорогостоящий анализ активности не обеспечивает сравнимости результатов. Некоторые авторы предлагают относительно простые инструментальные методы, как, например, определение белка в препарате. Однако в связи с тем, что в качестве кормовых добавок часто используют мультиэнзимные комплексы, содержащие разные активности, такие методы дают только ориентировочные данные.
Кроме того, имеются объективные различия ферментных препаратов одного и того же назначения, связанные с методом изготовления, в частности с природой и свойствами продуцентов (грибы, бактерии), что отражается на условиях проведения ферментативной реакции (рН, температуре, продолжительности гидролиза). В результате потребителю остается ориентироваться на рекомендуемые в инструкциях по применению нормы ввода, которые предлагается принимать на веру [7, 13].
На практике мы видим, что определение активности ферментов показывает нам активность того или иного энзима, входящего в коммерческий продукт. Эта активность говорит о «живучести» фермента [12]. Что делать, если продукт является мультиэнзимной композицией? Надо определять активность всех энзимов, входящих в состав? Или обратиться к возможности определить количество конечного продукта, который накапливается в результате реакции «фермент – субстрат»?
Продукт реакции, т. е. моносахарид, который, как правило, является редуцирующим (восстанавливающим), можно определить несколькими способами. Одним из общепринятых способов является метод с ДНС-реактивом (3,5-динитросалициловая кислота) [15].
В аспекте всех указанных причин мы в итоге имеем огромное количество коммерческих продуктов – мультиэнзимных композиций, которые невозможно ни адекватно оценить их активность, ни их эффективность. В результате конечные потребители – производители мяса птицы и яйца, вынуждены проводить производственные испытания для подбора наиболее эффективного продукта на рынке, который удовлетворял бы их требования по цене и окупаемости затрат на него. Эти производственные испытания связаны с финансовыми и трудовыми затратами, отвлекая ресурсы предприятия на побочную деятельность, которая не связана с производством.
Рядом авторов [1, 8, 9] была проведена большая работа по сравнительному анализу значительного ряда ферментных препаратов по единой, ими установленной единице по ксиланазной, глюканазной и целлюлазной активности. Однако она также была проведена с использованием какой-то условной единицы активности, которая ничего не говорит потребителю об эффективности фермента.
Таким образом, активность ферментов в единицах может быть полезна только для оценки жизнеспособности фермента или его наличия, скажем, в комбикорме после грануляции или экструдирования и нет возможности полагаться на единицы активности ферментов в производственных условиях, где характеристикой фермента может служить только определение его эффективности. Либо путем проведения производственных испытаний, как делается сейчас, либо в кормовых тестах in vitro в приближенных к желудочно-кишечному тракту (ЖКТ) условиях по температуре и рН среды.
В качестве подведения итогов по этой проблеме надо сказать, что ситуация, которая сложилась в кормлении животных и кормопроизводстве, такова, что специалисты по кормлению комбикормовых заводов, технологи и зоотехники животноводческих предприятий не могут полагаться на предлагаемые им методы оценки активности ферментных препаратов, опираясь на определение количества тех или иных единиц активности. Равно как и какой-то, скажем, единой единицы активности, которая была бы кем-то установлена. Эта ситуация на сегодня предполагает проведение предварительных производственных испытаний любого ферментного продукта, ранее не применяемого на данном предприятии, либо полагаться на рекомендации коллег и применять, полагаясь на веру. Это утверждение не касается кормовых фитаз в силу ряда причин, которые в этой работе мы не рассматриваем.
В экспериментальной энзимологии, конечно, остается необходимость проведения оценки единиц активности ферментов, т. к. это фундаментальное понятие в биохимии и касается не только кормовых, но и любых других ферментов, в первую очередь эндогенных. В лабораторных условиях, с научной точки зрения, такие методики приемлемы для оценки активности ферментов.
Указанные методы определения активности характеризуют фермент с точки зрения его активности, но не эффективности. Активность, как было сказано выше, это работа фермента в «рафинированных» условиях при определенной температуре, рН, в установленном интервале времени и с химически чистым субстратом (зачастую условия которых далеки от условий в ЖКТ), которая показывает качество или, так сказать, его жизнеспособность с учетом срока годности, термостабильности и стабильности при хранении.
Целью работы была разработка и валидация методики измерения эффективности in vitro различных коммерческих продуктов кормовых ферментов в нашей модификации, как было описано выше в условиях НИЦ «Черкизово».
Материал и методы исследований
Экспериментальная часть работы была проведена нашей группой в условиях НИЦ «Черкизово». Мы хотим ввести понятие «эффективность – in vitro» фермента – это способность фермента сделать работу по разрушению субстрата с высвобождением моносахарида(ов) в «полевых» условиях in vitro, т. е. при температуре, приближенной к температуре в ЖКТ – 39 °С, рН приближенной к рН ЖКТ – 4,01 и 6,89, время – 1 ч, а субстрат сложный, в виде измельченного зернового сырья и зерносмеси, а также с учетом ингибиторов ферментов (мультиэнзимные композиции различных производителей).
Кроме того, на наш взгляд, имеет большое практическое значение в оценке эффективности поведение ферментов при смене рН с 4,01 на 6,89 и с 6,89 на 4,01, симулируя переход химуса в разные отделы ЖКТ, где также меняется рН среды с кислой в нейтральную и с нейтральной в кислую. Определенная таким образом эффективность может предсказать работу (результат) того или иного ферментного (или комплексного) препарата в конкретных условиях на конкретном сырье и/или структуре комбикорма до того, как этот ферментный препарат будет использоваться в кормлении. Определить эффективность можно путем проведения кормовых тестов по увеличению питательности кормового сырья под действием ферментов (Марков А. В., 2003) в нашей модификации. В качестве контроля для сравнения используется тоже сырье и те же условия, но без применения ферментного препарата.
В опыте использовалось измельченное зерно на мельнице с диаметром сита 1 мм, залитое буфером с рН 4,01 (калий-фталевокислый буфер) или рН 6,89 (калий-фосфатный буфер) и инкубированное на водяной бане при температуре 39 °С в течение 1 ч, затем бралась надосадочная жидкость после центрифугирования и исследовалось количество сахаров методом ДНС-реактива при длине волны 540 нм. Затем рН менялась с 4,01 на 6,89 (использовали 0,1Н раствор КОН) и с 6,89 на 4,01 (использовали 0,1Н раствор HCl) и снова инкубировалось в течение 1 ч при температуре 39 °С и снова исследовалось количество сахаров в надосадочной жидкости.
В качестве контроля использовали тоже измельченное зерно, залитое такими же буферами, но без добавления ферментов. Эффективность определялась по приросту количества выделенных сахаров под действием разных мультиэнзимных продуктов к контролю, выраженное в процентах. Контроль был принят за 100 %. Из зерновых, применяемых в кормлении, мы использовали пшеницу, ячмень, кукурузу (все зерно было предыдущего урожайного года более 6 мес хранения) и зерносмесь, состоящую из пшеницы – 35 %, ячменя – 20 %, кукурузы – 30 %, жмыха подсолнечного – 15 % (табл.).
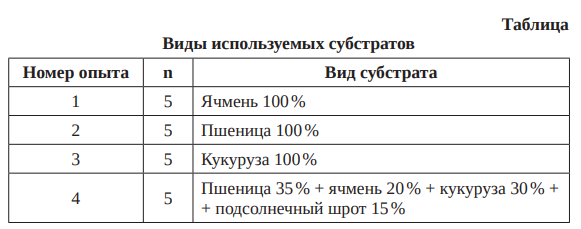
Результаты исследований и их обсуждение
Было продемонстрировано, что конечный продукт ферментативной реакции может выступать в качестве рабочего индикатора эффективности фермента. Это простой, быстрый и разумный способ оценки эффективности ферментов, который может использоваться в условиях производственных лабораторий. Он дает четкие и сопоставимые значения, что может дать предварительный результат при оценке возможности их использования для конкретного рациона и различного кормового сырья.
Влияние субстратов
Все используемые субстраты имели одинаковую степень помола, количество и влажность, поэтому различие в высвобождении свободного сахара должно быть связано только с изменениями экспериментальных параметров: рН, температуру и использованных ферментов.
Мы выявили значительную разницу в эффективности ферментативного гидролиза на разных субстратах. На рис. 1 показаны результаты для 100 % ячменного субстрата. Количество выделенных изолированных сахаров было самым высоким (~ 180 % к контролю) для этого субстрата по сравнению с другими (рис. 1–4). Наименьшую эффективность продемонстрировал кукурузный субстрат в присутствии фермента 2: практически нулевая. Из сравнения рисунков видно, что эффективность гидролиза для всех четырех субстратов (и мы предполагаем, что для всех коммерчески используемых их комбинаций) сильно зависит от применяемого фермента.
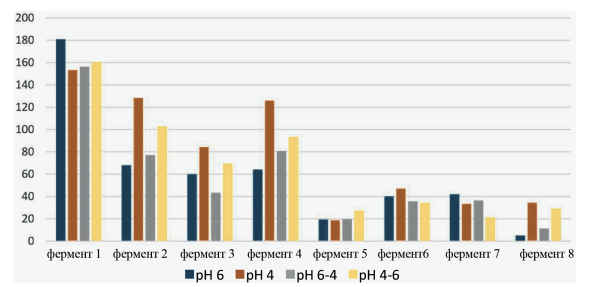
Рис. 1. Эффективность ферментного гидролиза полисахаридов ячменя (опыт 1)*. Примечание: * Не указаны товарные марки ферментов, т. к. в этой работе было главным показать принцип работы метода, а не оценку конкретных коммерческих продуктов.
Действие ферментов
Хорошим ориентиром для правильной работы метода является хорошая корреляция между действием одних и тех же ферментов на разные субстраты. Метод достаточно чувствителен, чтобы выявить даже незначительную разницу в эффективности ферментов. Фермент 5 дает наименьшее количество изолированных сахаров, а фермент 1 – наибольшее. Это хорошо согласуется с нашими ожиданиями и предыдущими исследованиями.
Большинство используемых ферментов оказывают одинаковое влияние на количество свободного сахара на каждом используемом субстрате: фермент 1 дает самый высокий выход сахара, за ним следуют фермент 2, фермент 4, фермент 6 и самый низкий – фермент 5. Этот порядок хорошо соответствует тому, что мы ожидали, и то, что другие авторы получали другими методами.
Фермент 7 демонстрирует различную эффективность на нескольких различных субстратах. Для ячменя он довольно низкий ~20–40 %, что в 5 раз меньше, чем изолированный сахар, выделяемый ферментом 1 в том же субстрате, т. е. максимальное значение на этом субстрате. Для ячменя этот фермент 7 является одним из самых низких по количеству свободного сахара. Когда мы смотрим на пшеничный субстрат (рис. 2), фермент 7 имеет гораздо более высокую эффективность, почти такую же, как фермент 1. Для сравнения, эффективность фермента 1 ~55–110 % к контролю, в то время как фермент 7 демонстрирует 30–110 % высвобождения свободного сахара.
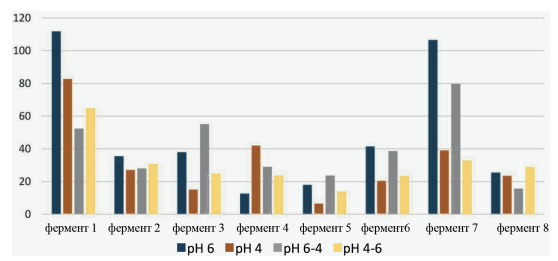
Рис. 2. Эффективность ферментного гидролиза полисахаридов пшеницы (опыт 2)
В кукурузном субстрате наибольшее значение свободного сахара наблюдалось в присутствии фермента 1 ~55–95 %, а в присутствии фермента 7 значение составляло 25–50 % (рис. 3). Это изменение величины следует объяснить разным действием фермента в присутствии разных субстратов, в частности крахмала, а не ошибкой экспериментальной методики.
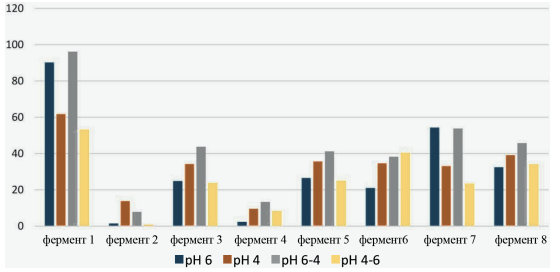
Рис. 3. Эффективность ферментного гидролиза полисахаридов кукурузы (опыт 3)
Остальные ферменты действовали предсказуемо во всех субстратах, что свидетельствует не только о надежности метода оценки, но и о его чувствительности.
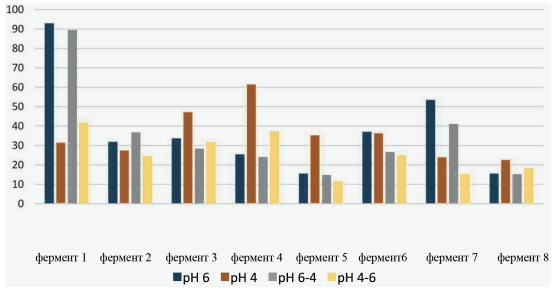
Рис. 4. Эффективность ферментного гидролиза полисахаридов зерносмеси (опыт 4)
Влияние рН
Разница в pH, используемая в ходе эксперимента, была направлена на моделирование внутренней среды в разных отделах ЖКТ и симуляция перехода химуса в различные отделы. На рис. 1–4 значения pH следующие:

Различный рН среды оказывает сильное влияние на результаты. Например, при использовании ячменя в качестве субстрата в присутствии фермента 1 максимальное выделение свободного сахара было отмечено при рН 6 ~180 %. Тот же процесс, но при pH 4 дает 155 %, что примерно в 1,2 раз меньше.
Различные субстраты проявляют разную чувствительность к изменениям рН. Для ячменя он достаточно низкий. Наибольшая разница в выделении свободных сахаров у ячменя была с ферментом 4: pH6 ~65 %, pH4 ~130 %, разница в 2 раза. Для пшеницы наибольшая разница в высвобождении свободных сахаров была с ферментом 7: pH4–6 ~35 %, pH6 ~110 %, т. е. разница почти в 3 раза.
Следует отметить, что ни один рН среды не гарантировал более высокого выхода свободных сахаров: в присутствии разных ферментов реакция субстрата была разной. Иногда pH 4 давал более высокое значение, иногда pH 6. Что говорит о разных рН оптимумах различных ферментов и скорости их работы.
Заключение
В результате проведенной работы нами сделаны следующие выводы:
1. Указан способ изменения рН буферных растворов в виде имитации перемещения химуса в разные отделы желудочно-кишечного тракта.
2. В работе использован известный классический метод с использованием ДНС-реактива (восстановление 3,5-динитросалициловой кислоты до 3-амино-5-нитросалициловой кислоты под действием восстанавливающих сахаров, имеющей красно-оранжевую окраску, интенсивность окраски мы определяли спектрофотометрически при длине волны 540 нм).
3. Использованы единицы оптической плотности окраски реагента в надосадочной жидкости. ДНС-реактив рассчитывали по градуировочному графику, построенному для глюкозы [14, 15].
4. Анализ имитирует пищеварение, т. к. рН 4 является более распространенным рН в зобе и железистом желудке, учитывая буферную способность корма повышать рН (ощелачивание), а рН 6,9 является более распространенным рН в тонком кишечнике. Подробнее об обзоре данных рН в различных отделах кишечника птицы приведены у M. Bedford, G. Partridge [12]. Мы взяли средние цифры рН приведенных значений.
5. Основная цель – получить в испытаниях in vitro все редуцирующие сахара, полученные в результате разрушения различных зерновых субстратов НПС. По нашему мнению, максимальной водоудерживающей способностью могут обладать арабиноксилан и ксилан. Сама ксилоза, находящаяся вне полимерных комплексов, обладает меньшей водоудерживающей способностью, что вызывает уменьшение вязкости химуса под действием ксиланаз. Полученный состав восстанавливающих сахаров под действием ферментов и определяет их эффективность. Чем выше количество моносахаридов, тем больше доступной энергии можно получить, и это снижает вязкость химуса. Количество высвобожденной ксилозы также указывает на эффективность ферментной композиции.
6. Результаты показались нам интересными, поскольку эффективность, т. е. количество выделенных сахаров, варьировала в зависимости от мультиферментного состава, вида зернового сырья или их смеси, а также от изменения рН.
7. Полученные результаты свидетельствуют о возможности подбора эффективной мультиферментной композиции для конкретного сырья, конкретной структуры рациона еще до производственных испытаний, а также с высокой долей вероятности подтвердить матричные значения ферментов по энергии, поскольку доля дополнительно выделенного сахара есть не что иное, как дополнительная доступная энергия.
8. Сегодня лабораториям требуются простые и доступные способы сравнения коммерческих ферментных препаратов. Прикладная, рутинная кормовая энзимология сегодня нуждается в простых и дешевых методах скрининга, которые могут быть доступны не только крупным агрохолдингам, но и небольшим лабораториям на комбикормовом заводе или птицефабрике.
КОРОТКО О ВАЖНОМ
ОТХОДЫ ДОЛЖНЫ СТАТЬ УДОБРЕНИЯМИ
В конце прошлого года в Госдуму внесли законопроект «о навозе и помете», который определяет правовые основы обращения продуктов жизнедеятельности сельскохозяйственных животных в целях обеспечения их эффективного вовлечения в хозяйственный оборот как источника повышения плодородия почвы
Проблема существует, и она очень серьезна. Как рассказал глава регионального отделения Партии дела в Воронежской области, председатель Совета директоров Верхнехавского агрохолдинга А. Пермяков, в России на фоне рекордного роста цен на минеральные удобрения вырос спрос на органические отходы птицеводческих и животноводческих предприятий. «Депутаты наконец задумались о том, чтобы навоз и помет перестали быть агрохимикатами и отходами, а превратились в биологически безопасное удобрение, как это было, замечу, во все времена», – подчеркнул промышленник.
По его мнению, если новый закон будет принят, как в Европе, это будет прекрасно. Там навоз не является отходами в какой-либо категории, а считается удобрением, который фермер абсолютно вправе вносить на свои поля или на поля соседей по договоренности (по меркам, например Дании, на двух свиноматок должен приходиться 1 га пашни) в определенное время года – весной и осенью. Остальное время навоз находится в лагуне.
«Однако в нашей стране всегда есть опасность того, что примут не европейский образец, а нечто похожее по форме, но обложат дополнительными условиями так, что ничего не изменится по сути. А может, станет еще хуже», – считает эксперт.
Кроме того, А. Пермяков отметил необходимость того, чтобы новый законопроект наконец дал четкое и понятное определение термину «отходов». «Нужно снять противоречия, которые сегодня здорово мешают бизнесу и позволяют зарабатывать на толковании нечистоплотным на руку людям», – заключил он.
Источник: https://kvedomosti.ru


