Введение
Новообразования центральной нервной системы (ЦНС) составляют почти 4,8–8 % от общего количества злокачественных опухолей. При этом с каждым последующим годом регистрируется неуклонное повышение их числа [1, 3]. Прежде всего это глиомы различной степени злокачественности, первичные лимфомы ЦНС и метастазы различных первичных злокачественных новообразований экстракраниальной локализации. В их патогенетической цепочке развития и роста прослеживается важный механизм — неоангиогенез. SWI-метод, который, в отличие от рутинных последовательностей МРТ, с высоким разрешением позволяет визуализировать новообразованные патологические сосуды, микрокровоизлияния в структуре опухоли, что дополняет возможности дифференциальной диагностики различных опухолей головного мозга.
Неоангиогенез в опухолях головного мозга
Неоангиогенез, или формирование новых микрососудов на основе уже существующей в ткани пораженного органа сети сосудов, — необходимое условие роста солидных опухолей и формирования отдаленных метастазов различных анатомических локализаций, включая структуры головного мозга [12]. Индуцирующими неоангиогенез факторами в первую очередь служат изменения, происходящие внутри самой опухоли: изменения структуры микроциркуляторного русла опухолевой ткани, усиление гипоксии, адаптация опухолевых клеток и синтез ангиогенных факторов клеточного роста. По причине аномального расположения кровеносных сосудов в ткани опухоли создается хаотичный поток крови, что приводит к выраженной гипоксии — ключевому индуцирующему фактору в процессе ангиогенеза [2].
Новообразованные сосуды в опухолях головного мозга являются «несовершенными» по строению своей стенки, в силу этого в структуре новообразования достаточно часто встречаются как микро-, так и макрокровоизлияния, визуализация которых может помочь в определении степени злокачественности новообразования [4].
В ответ на гипоксию в опухоли активируется синтез транскрипционных факторов, например, индуцируемых гипоксией (HIF-1 и HIF-2) [10]. После чего последние связываются с энхансерной последовательностью гена VEGF, который активирует экспрессию эндотелиального фактора роста сосудов (VEGF), VEGF — ключевой белок, посылающий эндотелию сигнал к росту сосудов и регулирующий миграцию, пролиферацию и выживание эндотелиальных клеток [11]. В результате альтернативного сплайсинга образуется несколько изоформ мРНК: VEGFA, VEGFB, VEGFC и VEGFD. Ключевую роль в стимуляции ангиогенеза играет VEGFА, который связывается и активирует два тирозинкиназных рецептора на ЭК: VEGFR1 и VEGFR2 [42].
В ЦНС рецептор VEGF, помимо активации неоангиогенеза, осуществляет нейротрофическую и нейропротекторную функции [43]. Другой системой в васкуляризации солидных опухолей служит сигнальный путь основного фактора роста фибробластов (bFGF) и рецептора фактора роста фибробластов (FGFR) [27, 44]. Активация этого сигнального пути приводит к стимуляции пролиферации ЭК эктодермального и мезодермального происхождения. Помимо прочего, bFGF синергически увеличивает активность VEGF. Эти две молекулы (VEGF и bFGF) инициируют переход опухоли в ангиогенную фазу роста («angiogenic switch»).
Глиобластомы по мере своего роста обладают крайне высокой способностью продуцировать ангиогенные факторы и стимулировать рост патологических сосудов в своей структуре, обеспечивая себя кислородом, питательными веществами [9]. По данным Dulak J. (2005) и Fidler I. J. (2002), без снабжения новыми кровеносными сосудами размер опухоли может достигать объема около 2 куб. мм, поскольку питание опухоли посредством диффузии кислорода может осуществляться на расстоянии 100–200 мкм [9, 20]. В исследовании H. Takeuchi et al (2007) у 19 пациентов с первичными лимфомами ЦНС при определении уровня экспрессии фактора VEGF и плотности микрососудистой пролиферации получили следующие результаты: только у 3 пациентов из 19 выявлялась степень пролиферации более 50 %, у 2 — 25–50 % и у 4 — менее 25 %, в остальных случаях экспрессия не определена, при этом повышенная концентрация VEGF ассоциировалась с плохим прогнозом [23, 40, 45]. В работе Trude G. Simonsen et al (2015) все популяции опухолевых клеток метастазов меланомы показали высокую пролиферативную активность, что было во многом вызвано высокой плотностью микрососудов и экспрессии фактора VEGF-A [46]. Некоторые авторы, Fidler I. J. (2002), Winkler F. (2004), в своих исследованиях на мышах показали, что метастазы рака — колоректального рака, рака молочной железы, меланомы, рака легкого — в своей структуре имели малое количество расширенных патологических сосудов с множественными мостиками, но по мере своего роста их количество увеличивалось за счет так называемого «нерастущего ангиогенеза», смысл которого состоит в том, что пролиферация сосудов в опухоли происходит путем деления эндотелиальных клеток ранее образованных сосудов при помощи BrdU+, CD31 + клеток [12, 48].
Наличие микрокровоизлияний в структуре неврином является надежным дифференциально-диагностическим критерием, например, с менингиомами [29]. Предполагается, что источником этих микрокровоизлияний является спонтанный тромбоз аномальных сосудов в матриксе опухоли. Клетки шванномы обладают фагоцитарными свойствами и могут депонировать продукты деградации гемоглобина. Для сравнения, менингиомы обычно не проявляют сходных изменений в виде микрокровоизлияний, несмотря на то, что являются богато васкуляризированными опухолями [22, 31, 32, 51].
SWI (Susceptibility weighted imaging). МРТ в режиме изображений, взвешенных по магнитной восприимчивости, в диагностике опухолей головного мозга
Традиционно МРТ-изображения, взвешенные по магнитной восприимчивости, рассматривались как источник искусственных артефактов в МРТ. Это убеждение было оправдано, поскольку из-за наличия артефактов не удавалось получить удовлетворительный контраст мягких тканей и вещества головного мозга. Магнитная восприимчивость является неотъемлемым свойством биологических тканей. [41]. E. M. Haacke и J. R. Reichenbach (2005) удалось избавиться от большинства фазовых артефактов, объединив изображения фазы и магнитуды в одном изображении [19, 38, 39]. Впервые SWI успешно использовалась для диагностики сосудистых мальформаций головного мозга [26].
Магнитная восприимчивость представляет собой физическую величину, которая определяется степенью намагничивания материала приложенным магнитным полем. Магнитная восприимчивость ткани Х равна отношению намагниченности М в ткани к силе приложенного магнитного поля Н, то есть Х = М / Н. [5]. Последовательность SWI объединяет магнитудное T2* изображение с фильтрованным фазовым изображением, полученным с помощью последовательности градиентного эха. В то время как T2* взвешенное изображение уже обеспечивает некоторый контраст, SWI еще больше усиливает контраст между тканями различной магнитной восприимчивости. Методика SWI основана на последовательности градиентное эхо (GE), но при этом обладает более высокой чувствительностью и восприимчивостью по сравнению с обычными T2 GE взвешенными последовательностями, потому что обладает высокоразрешающим длинным TE, скомпенсированным по потокам и содержит информацию о фазе в каждом вокселе изображения [17, 21, 30, 34].
Как уже было указано, SWI магнитудные и фазовые МР-данные объединяются и создается фазовая маска. Умножение их на оригинальные изображения в соответствующем масштабе приводит к набору данных SWI окончательной величины. Информация о магнитуде и фазе необходима для правильной характеристики ткани и объединяется для создания SWI-изображения [18]. В дальнейшем эти данные дополнительно обрабатываются с помощью алгоритма минимальной интенсивности проекции (minIP), чтобы получить изображения, включающие в себя по 3–10-миллиметровых пластов изображений. Эти мини-изображения, таким образом, визуализируют непрерывность извилистых венул, ослабляя сигнал от вещества мозга [17].
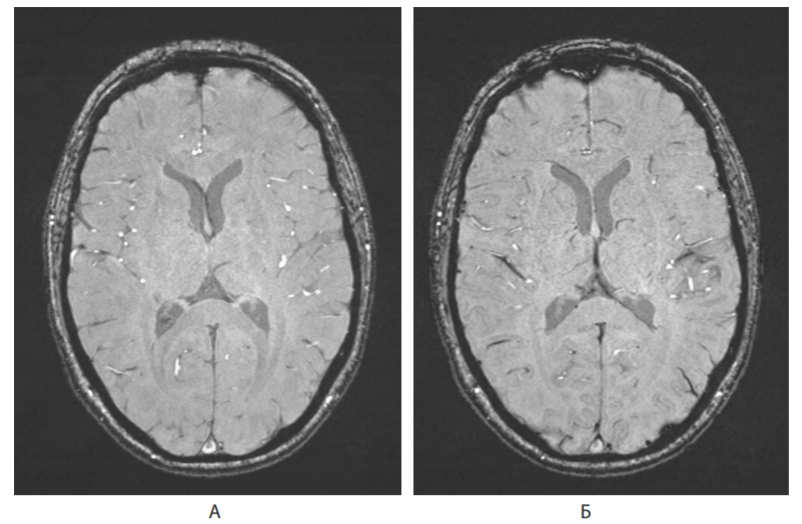
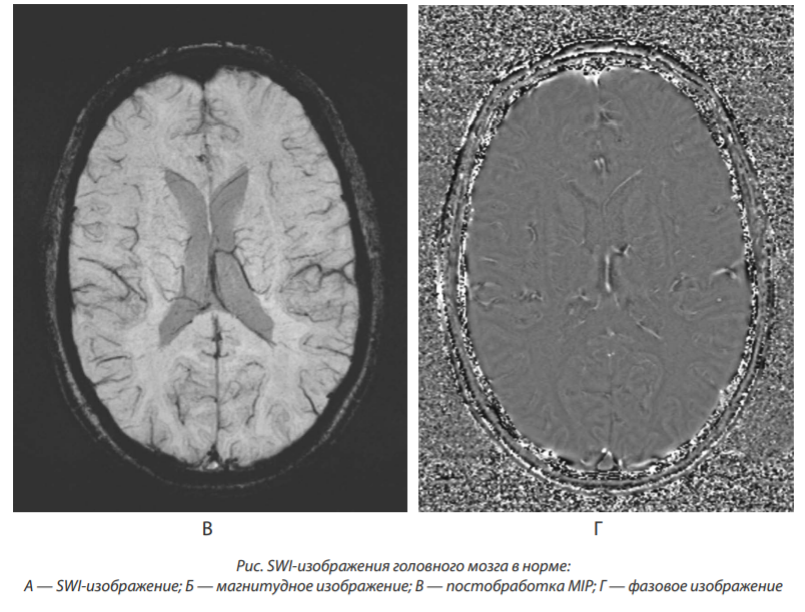
На рисунке показаны SWI-изображения головного мозга в норме. В основе оценки поражения вещества головного мозга в режиме SWI являются участки гипоинтенсивного МР-сигнала структуры — ITSS (Intratumoral Susceptibility Signals) — внутриопухолевые сигналы магнитной восприимчивости, которые не могут быть визуализированы при рутинных последовательностях МРТ. Park et al. определяли ITSS как точечные и (или) линейные гипоинтенсивные структуры, сливающиеся или нет, определяемые в матриксе опухоли [31].
Точечный гипоинтенсивный сигнал расценивается как микрогеморрагия, а линейный сигнал как внутриопухолевый кровеносный сосуд, оба данных паттерна распространены в злокачественных опухолях ЦНС [49].
Качественные и количественные характеристики ITSS были определены, чтобы использовать их в дифференциальной диагностике патологических очагов в головном мозге. Park et al. классифицировали ITSS на 3 категории: точечные структуры, линейные структуры, точечные и линейные структуры. Позже они разделили ITSS на 4 степени для полуколичественного анализа изменений: класс 0 был определен как отсутствие ITSS, 1-я степень была определена как 1–5 точечных и (или) линейных ITSS, 2-я степень — как 6–10 точечных и (или) линейных ITSS, 3-я степень — как 11 и более точечных и (или) линейных ITSS на срезе с максимальными изменениями данного показателя [31, 32]. Степени SWI 0 и 1 были оценены как низкие, а 2-я и 3-я — как высокие. Глиомы были классифицированы в соответствии с данными критериями по двум группам — как доброкачественные (1-й и 2-й Grade) и злокачественные (3-й и 4-й Grade).
МРТ в режиме SWI в дифференциальной диагностике глиом различной степени злокачественности, первичных лимфом, менингиом, неврином и метастазов в головном мозге
По данным Li et al. (2009), SWI превосходит обычные методы при визуализации мелких сосудов и микрогеморрагий в астроцитомах головного мозга. А. Radbruch (2013) в своем исследовании проводил предоперационную дифференциальную диагностику первичных лимфом ЦНС и глиобластом, в котором из 117 глиобластом 109 показали наличие ITSS 3 степени, в 14 первичных Вклеточных лимфом ЦНС степень ITSS равнялась 0, однако в одном наблюдении при Т-клеточной лимфоме степень ITSS была 3.
Чувствительность метода дифференциации глиобластом от первичной лимфомы ЦНС составляла 91,2 % и специфичность 93,3 %. Тест Стьюдента выявил значительную корреляцию между размером глиобластом и появлением ITSS (p < 0,008). Наличие ITSS в единственной Т-клеточной лимфоме было обусловлено наличием микрокровоизлияний в её структуре, что позже было доказано результатами гистологического исследования операционного материала [36].
В ретроспективном исследовании P. Kickingereder et al. (2014) авторы оценивали диагностическую значимость МРТ в режиме SWI в дифференциальной диагностике первичных лимфом и глиальных опухолей Grade III и IV перед операцией. ITSS визуализировался у 6 из 19 (32 %) пациентов с первичными лимфомами ЦНС и у 23 из 28 (82 %) пациентов с глиобластомами. При полуколичественной оценке степени ITSS, для первичных лимфом ЦНС последний составил 1,58 ± 0,9 и 2,14 ± 0,71 для глиобластом (P = 0,01). В 68 % (13 из 19) пациентам с первичными лимфомами ЦНС и 82 % (23 из 28) пациентам с глиобластомами при помощи SWI получилось поставить правильный диагноз на дооперационном этапе, который был подтвержден гистологическим исследованием. Чувствительность и специфичность SWI в дифференциальной диагностике первичных лимфом ЦНС и глиобластом составила 91,2 и 93,3 % соответственно [25].
Чувствительность и специфичность SWI в дифференциальной диагностике первичных лимфом ЦНС и глиобластом в исследовании S. Peters et al. (2012) составила 90,5 и 100 % соответственно [35]. J. Furtner et al. (2014) обнаружили, что значения ITSS (p = 0,001) были значительно выше в глиобластомах нежели в первичных лимфомах ЦНС. Чувствительность, специфичность и точность ITSS составила более 95 %. [16].
Проведенный метаанализ Yangzong Wu et al. (2018) из 714 пациентов роли МРТ в режиме SWI в дифференциальной диагностике первичных лимфом ЦНС и глиом головного мозга высокой злокачественности показал чувствительность и специфичность данного метода в 92 и 87 % соответственно [50]. В исследовании Yu Lin (2014) результаты показали значительную разницу в степени ITSS и степени злокачественности глиом. Тем не менее, в 5 % случаев в доброкачественных глиомах наблюдались средние и высокие уровни ITSS, что могло быть связано с умеренно повышенной неоваскуляризацией как у доброкачественных, так и у злокачественных глиом в результате совместной мутации в гене 1p/19q. При проведении дифференциальной диагностики между доброкачественными и злокачественными глиомами путем полуколичественного анализа ITSS (SWI) чувствительность и специфичность данной методики составила 100 и 93,33 % соответственно [28].
В исследовании J. Saini (2017) сравнивали степени ITSS среди глиом различного уровня злокачественности, было показано, что в злокачественных опухолях преобладали более высокие степени ITSS (r = 0,574 и p < 0,001). Однако, не было показано достаточного уровня статистической значимости при парном сравнении глиом II и III степени злокачественности (р = 0,861).
Значительные различия в степени ITSS были отмечены при сравнении глиом III и IV степени злокачественности (p < 0,001). Чувствительность и специфичность SWI (ITSS) в дифференциальной диагностике глиом III и IV степени злокачественности составила 77 и 70 % соответственно, в дифференциальной диагностике глиом II + III и IV степени злокачественности 77 и 78 % соответственно. В 5 из 70 глиобластом не визуализировалось никаких признаков наличия ITSS, возможными причинами отсутствия ITSS в глиобластомах может быть микрососудистая пролиферация, которая выходит за рамки разрешающей способности МРТ сканеров с напряженностью магнитного поля 3Т [40]. J. Fu et al. (2014), проведя полуколичественный анализ (SQ) ITSS у 65 пациентов с гнойными абсцессами, глиобластомами и метастазами в головном мозге, показали, что у 18 (85,8 %) из 21 абсцесса степень ITSS была определена как I или II, в 19 (90,5 %) из 21 глиобластомы степень ITSS была определена как III. В метастазах распределение было следующим. ITSS I в 7 (30,4 %), ITSS II и III в 4 (17,4 %) соответственно, ITSS III в 8 (34,8 %). Чувствительность и специфичность ITSS в дифференциальной диагностике абсцессов и глиобластом головного мозга составила 85,7 и 90,5 % соответственно. Чувствительность и специфичность ITSS в дифференциальной диагностике абсцессов и метастазов в головном мозге — 85,7 и 52,2 % соответственно. Чувствительность и специфичность ITSS в дифференциальной диагностике метастазов и глиобластом составила 76,2 и 65,2 % соответственно [15].
X. Li et al. (2015) проводили дифференциальную диагностику глиальных опухолей разных степеней злокачественности, используя МРТ в режиме SWI и оценивая ITSS в матриксе опухоли. Авторы получили следующие результаты: степень ITSS для глиом низкой степени злокачественности была достоверно ниже, чем в глиомах Grade III–IV (P < 0,01), а ITSS глиом Grade II была ниже глиом Grade III и IV [49]. Данные результаты были cхожи с данными исследования Park et al (2009), M. Hori et al (2010), K. Pinker et al (2006) [21, 24, 33]. A. Radbruch et al. проводили полуколичественную процентную оценку (percentagewise quantitative-PQ) ITSS у пациентов с метастазами в головном мозге из различных первичных очагов (меланомы, рака молочной железы, рака легкого) и получили следующие результаты. Чувствительность и специфичность методики в дифференциальном диагнозе между метастазами РМЖ и метастазами меланомы составила 0,85 и 0,93 соответственно. Чувствительность и специфичность в дифференциальном диагнозе между метастазами меланомы и метастазами рака легкого составила 0,67 и 0,84 соответственно. Чувствительность и специфичность в дифференциальном диагнозе между метастазами рака легкого и метастазами РМЖ составила 0,85 и 0,47 соответственно [37].
В работе W. Zhang et al. (2009) у 45 пациентов раком легкого с метастазами в головном мозге оценивалась чувствительность метода SWI при сравнении с результатами T2* ВИ и T1 ВИ с внутривенным введением контрастного препарата. 89 метастатических очагов в головном мозге с микрокровоизлияниями были идентифицированы у 31 пациента с использованием SWI, 68 были идентифицированы у 23 пациентов с использованием T2* ВИ и 46 были идентифицированы у 14 пациентов с использованием CE-T1WI. Количество метастазов в головном мозге, обнаруженное с использованием SWI, было в 1,93 и в 1,31 раза больше числа, обнаруженного с использованием T1 ВИ и T2* ВИ соответственно [52].
В дифференциальной диагностике метастатического поражения головного мозга, первичными источниками которых являлись молочная железа и меланома, в исследовании Franceschi A.M. et al. (2016) SWI показала чувствительность и специфичность 96 и 81 % соответственно, поскольку в метастазах меланомы процентная количественная оценка PQ показала наибольший процент по сравнению с метастазами молочной железы 77 % против 55 % [14, 37].
В работе Di. Leva et al. (2016) произведен дифференциальный диагноз между глиомами разной степени злокачественности, метастазами из различных первичных очагов и лимфомами ЦНС. Авторы получили 81 % чувствительности и 89 % специфичности метода SWI (относительная интенсивность МРсигнала) при дифференциальной диагностике доброкачественных и злокачественных глиом (P < 0,01). Достоверные различия авторы получили сравнивая глиомы II grade с метастазами и менингиомами (P = 0,01) и глиомы IV grade и лимфомы ЦНС (P = 0,017) [7].
Выводы
Таким образом, МРТ головного мозга в режиме SWI позволяет с высокой точностью визуализировать сосудистые изменения в тканях на фоне неоангиогенеза (внутриопухолевые микро- и макрокрокровоизлияния, внутриопухолевые сосуды и артеривенозные шунты), что, в свою очередь, может повысить дифференциально-диагностические возможности МРТ при опухолях головного мозга.
Малое количество отечественных научных публикаций и сравнительно небольшое зарубежных работ по теме применения МРТ в режиме SWI в диагностике и дифференциальной диагностике первичных и вторичных опухолей головного мозга, а опубликованные результаты исследований применения SWI в дифференциальной диагностике опухолей головного мозга имеют достаточно противоречивые результаты, можно сделать вывод, что данная методика недостаточно раскрыта в литературе и требует дальнейшего изучения.


