
В. С. Малогулко
ВВЕДЕНИЕ
Технология in vitro гаметогенеза (IVG) обещает стать парадигматическим сдвигом в лечении бесплодия и репродуктивной медицине [1]. Процесс, включающий дифференцировку плюрипотентных стволовых клеток (ПСК), в частности индуцированных ПСК (иПСК), в зрелые, функциональные гаметы (сперматозоиды или ооциты), открывает беспрецедентные возможности [2]. Он может предложить решения для пациентов, утративших фертильность (например, в результате онкотерапии), для пар с неясным бесплодием, а также для нетрадиционных репродуктивных сценариев [3].
Однако этот сложный, многоэтапный процесс, полностью протекающий in vitro, обходит стороной строгие механизмы биологического контроля качества, отточенные миллионами лет эволюции in vivo [4]. Естественный гаметогенез включает жесткий отбор на генетическую и эпигенетическую целостность, происходящий в уникальной соматической нише гонад. Имитация этого процесса в культуральной чашке несет в себе значительные риски. К ним относятся накопление de novo мутаций, ошибки мейоза, приводящие к анеуплоидии, и, что наиболее критично, сбои в сложном процессе эпигенетического репрограммирования, включая стирание и восстановление геномного импринтинга [5].
Проблема усугубляется тем, что исходный материал (иПСК) может нести собственное бремя генетических и эпигенетических аномалий, включая остаточную эпигенетическую память о соматическом происхождении [6]. Таким образом, безопасность потомства, полученного с помощью IVG, становится главной нерешенной научной, этической и медицинской проблемой.
Целью данной работы является систематический анализ и критическая оценка существующих и предлагаемых методов контроля качества (КК) и безопасности гамет, полученных путем in vitro гаметогенеза.
Для достижения этой цели были поставлены следующие задачи:
• Систематизировать процесс IVG в виде многоэтапной модели с определением критических контрольных точек (ККТ) для оценки безопасности.
• Проанализировать и оценить применимость и ограничения методов генетического контроля качества (например, ПГТ методом NGS) на этапах ККТ-1 (ПСК) и ККТ-3 (мейоз).
• Выполнить углубленный анализ рисков эпигенетической нестабильности и методов их контроля на этапах ККТ-2 (репрограммирование) и ККТ-4 (зрелая гамета), уделяя особое внимание геномному импринтингу.
• Оценить методы функционального контроля качества (ККТ-4), используя данные о компетентности эмбрионов из животных моделей.
• Синтезировать выявленные риски и барьеры в контексте текущего регуляторного статуса IVG.
Научная новизна исследования заключается в разработке комплексной 4‑этапной модели контроля качества IVG и в обосновании тезиса о том, что не генетические, а именно эпигенетические аномалии представляют собой фундаментальный биологический, а не просто технический барьер для безопасного клинического применения IVG у человека, что подкрепляется видоспецифичными данными о сбоях репрограммирования.
МАТЕРИАЛЫ И МЕТОДЫ
Настоящее исследование представляет собой систематический и сравнительный анализ научной литературы. Методологическая база работы основана на качественном синтезе данных, извлеченных из рецензируемых публикаций, технических документов и аналитических отчетов. Были применены следующие подходы к исследованию. Для систематического обзора литературы был проведен поиск в библиографических базах данных Scopus, Web of Science (WoS) и PubMed. Поиск охватывал статьи, опубликованные преимущественно за последние 5–7 лет, для обеспечения актуальности данных. Для сравнительного анализа проводилось сравнение протоколов in vitro с процессами in vivo, а также сравнительный анализ данных, полученных на мышиных и человеческих моделях, для выявления видоспецифичных различий. В рамках контент-анализ технической документации были проанализированы актуальные руководства Международного общества исследований стволовых клеток (ISSCR) для понимания текущего регуляторного и этического консенсуса.
Основу исследования (более 90 % источников) составили публикации из высокоимпактных научных журналов (Scopus / WoS), включая обзоры и оригинальные исследования по темам IVG, эпигенетики, ПГТ и репродуктивной биологии. Ключевые слова для поиска включали, но не ограничивались «in vitro gametogenesis», «quality control», «safety assessment», «epigenetic stability», «genomic imprinting», «aneuploidy», «NGS», «PGT». Анализ был сфокусирован на извлечении данных о конкретных методах контроля качества, выявленных генетических и эпигенетических аномалиях, а также количественных метриках функциональной компетентности гамет in vitro по сравнению с in vivo контролями.
РЕЗУЛЬТАТЫ
Результаты анализа позволили, во‑первых, структурировать процесс IVG в виде последовательной модели контроля качества и, во‑вторых, оценить эффективность методов контроля на каждом из этих этапов.
Для систематизации рисков и методов их контроля, процесс IVG был разделен на четыре последовательных этапа, как показано на рис. 1, каждый из которых завершается Критической контрольной точкой (ККТ), требующей специфических методов валидации.

Рис. 1. Модель 4‑этапного контроля качества (ККТ) в процессе in vitro гаметогенеза. Fig. 1. Model of 4‑stage quality control (QC) in the process of in vitro gametogenesis
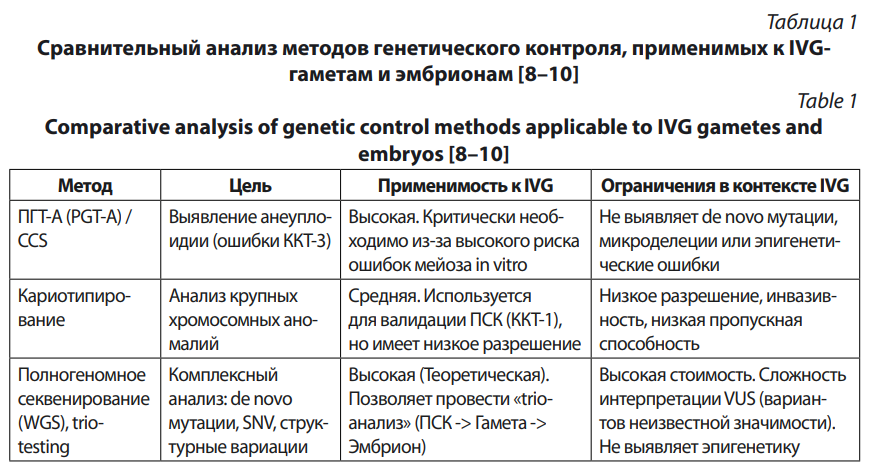
Процесс IVG уязвим для генетических аномалий на двух основных этапах: (1) в исходных ПСК (ККТ-1), которые могут нести соматические мутации из донорских клеток или накопить их в культуре, и (2) во время мейоза in vitro (ККТ-3), который является крайне сложным процессом и часто приводит к ошибкам [7].
В ККТ-3 риски заключаются в том, что ошибки мейоза in vitro приводят к высокому уровню анеуплоидии (неправильное число хромосом) в получаемых гаметах. Исследования показывают, что при попытках имитации мейоза in vitro большинство полученных эмбрионов имеют хромосомные аномалии, что делает их нежизнеспособными [8].
Предлагаемые методы контроля являются прямой адаптацией технологий, используемых в преимплантационном генетическом тестировании (ПГТ) при ЭКО. В ПГТ-А это реализуется через скрининг на анеуплоидию, М — через скрининг моногенных заболеваний, СП — структурных перестроек [9]. При этом, секвенирование последнего поколения (NGS) рассматривается как универсальный подход и «золотой» стандарт в настоящее время [10]. На моделях эмбрионов, полученных в результате ЭКО, показано, что полногеномное секвенирование полученного образца трофэктодермы, особенно в формате trio testing (сравнение геномов обоих родителей и эмбриона), позволяет с высокой точностью выявлять не только унаследованные, но и de novo патогенные варианты (SNV) и структурные аномалии. Этот же подход может быть применен к IVG [сравнение генома иПСК (ККТ-1) с геномом гаметы / эмбриона (ККТ-3/4)].
В табл. 1 представлен сравнительный анализ методов генетического контроля применительно к IVG.
Эпигенетический контроль является наиболее сложной и критической областью рисков. Гаметогенез in vivo включает два массивных события эпигенетического репрограммирования. Первым является стирание (Erasure). В примордиальных зародышевых клетках (PGCs) происходит почти полное стирание родительских эпигенетических меток, включая импринты [11]. Вторым является восстановление (Establishment), где в ходе созревания гамет устанавливаются новые, зависящие от пола, паттерны ДНК-метилирования, включая импринты [12].
Анализ выявил системные сбои на всех этапах эпигенетического репрограммирования in vitro.
Остаточная эпигенетическая память (ККТ-1): иПСК, полученные из соматических клеток, могут сохранять память о своем тканевом происхождении. Эта остаточная эпигенетическая информация может приводить к смещенной дифференцировке и аномальному развитию эмбриона [13].
Сбой стирания метилирования (ККТ-2) — это ключевой барьер. Исследования выявили фундаментальное видоспецифичное различие. Мышиные PGCLCs (клетки-предшественники гамет) in vitro способны к глобальному деметилированию, как и in vivo. Однако человеческие PGCLCs (hPGCLCs) in vitro не способны к адекватному деметилированию при культивировании и сохраняют аномально высокие уровни метилирования ДНК [2]. Это ставит под сомнение саму возможность адекватного эпигенетического репрограммирования человека in vitro при текущих протоколах.
Ошибки импринтинга (ККТ-2/4): некорректное стирание и / или восстановление геномного импринтинга является одним из главных рисков [14].
Аномалии гистоновых модификаций (ККТ-4): исследования in vitro созревания ооцитов (компонент IVG) показывают дерегуляцию репрессивных гистоновых маркеров (таких как H3K27me3 и H2AK119ub1) в генах, отвечающих за развитие, а также аномальное приобретение 5‑гидроксиметилцитозина (5hmC) [12].
Методы контроля включают анализ метилирования ДНК (например, бисульфитное секвенирование) для оценки импринтов и глобального метилирования, а также ChIPseq для гистоновых модификаций. Однако эти методы часто являются разрушающими и не могут применяться для гамет, предназначенных для репродукции [15].
Рассмотрим оценку методов функционального контроля качества (ККТ-4). Функциональная компетентность — это интегральный показатель качества гаметы, определяемый ее способностью участвовать в оплодотворении, формировать жизнеспособный эмбрион и приводить к рождению здорового потомства [16].
Данные из мышиных моделей, где технология IVG наиболее продвинута, демонстрируют резкое снижение функциональности по сравнению с in vivo контролем [17]. При использовании ооцитов, полученных in vivo (контроль) и in vivo спермы, процент живорождения составил 61,7 %. При использовании IVG-ооцитов (полученных из ЭСК) и in vivo спермы процент живорождения упал до 5,2 %. В более сложных протоколах (конверсия пола, XY иПСК -> ооциты) эффективность снизилась до 1 %.
Эти данные указывают на более чем 10‑кратное падение эффективности и функциональной компетентности. Причины этого сбоя носят молекулярный характер. Сравнение in vitro созревших (IVM) и in vivo ооцитов выявляет тысячи генов с дифференциальной экспрессией (DEGs). Исследования показывают от 1,864 [18] до 2,627 [12] DEGs у мышей. Выявленные DEGs часто связаны с нарушением метаболизма, в частности с путями окислительного фосфорилирования (OXPHOS), что указывает на высокий уровень метаболического стресса в условиях in vitro. IVG-ооциты демонстрируют значительно сниженную экспрессию ключевых материнских транскриптов, необходимых для раннего развития эмбриона, таких как Gdf9 и Mater [19]. В табл. 2 обобщены данные о функциональном разрыве между in vivo и in vitro гаметами.
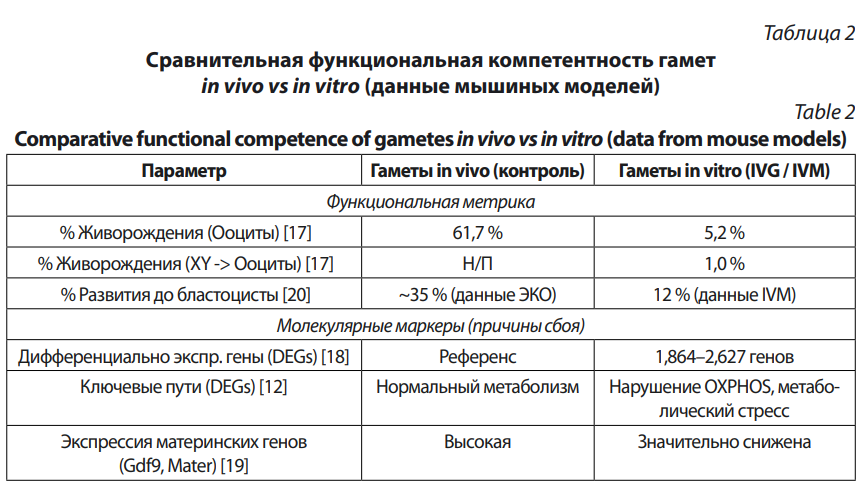
Таким образом, нынешние in vitro-протоколы не восстанавливают эпигенетическое состояние: остаются тканевая память, ошибки деметилирования и импринтинга, а функциональная компетентность гамет падает более чем в 10 раз в моделях. Требуются приоритетные фундаментальные исследования, недеструктивные методы контроля качества и строгая этико-регуляторная проверка до любой клинической трансляции.
ОБСУЖДЕНИЕ
Проведенный анализ результатов выявляет четкую иерархию рисков. Проблемы генетического контроля (ККТ-1 и ККТ-3), такие как анеуплоидия и de novo мутации, являются серьезными, но технически решаемыми. Развитие ПГТ-технологий методом NGS, полногеномное секвeнирование в рамках трио-теста, как показано в табл. 1, позволяет с высокой долей уверенности идентифицировать генетически аномальные гаметы или эмбрионы.
Напротив, проблемы эпигенетического контроля (ККТ-2 и ККТ-4) представляют собой фундаментальный биологический барьер. Результаты, представленные в табл. 2, являются лишь симптомом этого глубинного сбоя.
Ключевой вывод заключается в том, что в отличие от генетических ошибок, которые можно рассматривать как случайные дефекты в производственном процессе, эпигенетические аномалии в IVG являются системным сбоем самого производственного процесса. Данные о неспособности человеческих PGCLCs к деметилированию in vitro и сохранении остаточной памяти в иПСК показывают, что текущие протоколы гарантированно производят эпигенетически дефектный продукт.
Нельзя отфильтровать эпигенетически плохие гаметы, если весь процесс их производства фундаментально отличается от референсного in vivo. Этот сбой обусловлен отсутствием адекватной соматической ниши (гонадальной среды), которая in vivo направляет и контролирует эпигенетическое репрограммирование. Таким образом, проблема заключается не в контроле качества, а в создании качества.
Низкая функциональная компетентность и массовые транскриптомные аномалии подтверждают, что IVG-гаметы не эквивалентны in vivo гаметам. Это имеет прямое отношение к долгосрочной безопасности.
Необходимо провести экстраполяцию рисков, основываясь на данных из смежных областей вспомогательных репродуктивных технологий (ВРТ). Исследования показывают, что даже стандартное ЭКО, включающее всего несколько дней культивирования in vitro, связано с небольшим, но измеримым риском эпигенетических нарушений (например, дефектов импринтинга) и долгосрочных проблем со здоровьем у потомства, включая метаболические и поведенческие аномалии [21].
Процесс IVG включает несколько месяцев культивирования in vitro. Причем этот период совпадает с наиболее уязвимым окном в развитии — эпигенетическим репрограммированием [22]. Можно с высокой долей уверенности предположить, что эпигенетические риски IVG будут не просто сравнимы, а многократно амплифицированы по сравнению с ЭКО. Неизвестные долгосрочные последствия для здоровья потомства являются главным сдерживающим фактором.
Представленные научные данные о высоких рисках и низкой функциональности напрямую объясняют текущую строгую регуляторную позицию. В Руководстве ISSCR [23], которое служит де-факто международным стандартом, репродуктивное использование IVGгамет классифицируется как Категория 3A — исследования, которые запрещены к клиническому применению из‑за нерешенных вопросов безопасности и / или этических проблем.
В то же время, исследования самого процесса IVG, которые не включают перенос эмбрионов, разрешены (Категории 1 и 2) [24]. Это демонстрирует зрелый, научно-обоснованный подход: научное сообщество самоограничивается, признавая, что технология не готова. Эта позиция контрастирует с фрагментированными национальными законодательствами. Например, в США нет федеральных законов, прямо регулирующих IVG, но действуют строгие ограничения на федеральное финансирование исследований [25]. Регулятор HFEA (Великобритания) признает потенциал IVG, но также заявляет о преждевременности клинического использования [26].
Будущие усилия по контролю качества IVG должны быть сосредоточены на трех направлениях. Критически важно разработать методы оценки эпигенетического и транскриптомного статуса гаметы, не уничтожая ее, что позволило бы проводить отбор для переноса. Также важно создание in vivo-подобных систем. Усилия должны быть направлены на решение фундаментальной биологической проблемы. Разработка 3D-органных культур (искусственные яичники / семенники), которые лучше имитируют соматическую нишу, является ключом к получению эпигенетически здоровых гамет. Вместе с этим важны и стандартизация и автоматизация. Повышение воспроизводимости и качества протоколов IVG требует внедрения подходов из индустрии клеточной терапии, включая использование автоматизированных закрытых систем производства и ИИ-мониторинга.
ЗАКЛЮЧЕНИЕ
Проведенный анализ методов контроля качества и безопасности гамет, полученных путем in vitro гаметогенеза, выявил трехуровневую систему рисков.
Во-первых, генетический контроль (ККТ-1, ККТ-3) является технически решаемой задачей. Современные методы, такие как NGS и ПГТ, способны эффективно отбраковывать гаметы с анеуплоидией или de novo мутациями.
Во-вторых, функциональный контроль (ККТ-4) на мышиных моделях демонстрирует крайне низкую компетентность IVG-гамет по сравнению с in vivo аналогами, с падением эффективности живорождения более чем в 10 раз.
В-третьих, эпигенетический контроль (ККТ-2, ККТ-4) является главным нерешенным барьером. Анализ показал, что текущие протоколы IVG приводят к системным сбоям в эпигенетическом репрограммировании, включая остаточную память в иПСК и, что критично для человека, неспособность к адекватному глобальному деметилированию in vitro.
Таким образом, цели работы достигнуты: риски систематизированы, методы КК оценены, и эпигенетическая нестабильность идентифицирована как главный фундаментальный барьер.
Практическая значимость работы заключается в научном обосновании текущего регуляторного статуса. На современном технологическом этапе IVG-гаметы не могут считаться безопасными для репродуктивного применения у человека. Запрет ISSCR является полностью оправданным. Усилия научного сообщества должны быть сосредоточены не на ускорении клинического внедрения, а на решении фундаментальных проблем эпигенетической стабильности в in vivo-подобных системах и разработке адекватных, неразрушающих методов контроля качества.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
Финансирование
Исследование не имело спонсорской поддержки.
Авторы декларируют соответствие своего авторства международным критериям ICMJE.
Дата поступления рукописи в редакцию: 11.09.2025
Дата принятия рукописи в печать: 25.09.2025
CONFLICT OF INTEREST
The authors declares that there is no conflict of interest.
Funding
The author received no specific funding for this work.
The author declares that her authorship complies with the international criteria of the ICMJE.
Date of receipt of the manuscript by the editorial office: 11.09.2025
Date of acceptance of the manuscript for publication: 25.09.2025


