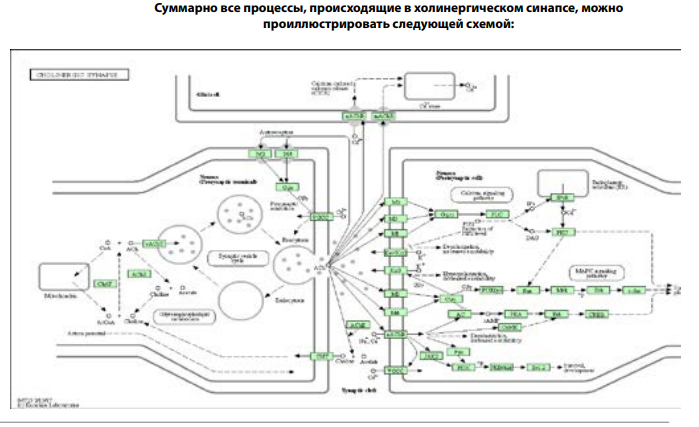
Передача сигналов между холинергическими нейронами и от нейронов к мышечным клеткам (нейро-нейрональная и нейромышечная трансдукция) происходит посредством синапсов. Они образованы мембранами двух контактирующих клеток, пресинаптической и постсинаптической, которые разделены узкой синаптической щелью.
Холинергическими являются:
• Нейроны ЦНС;
• Преганглионарные нейроны парасимпатического и симпатического отделов вегетативной нервной системы;
• Постганглионарные нейроны парасимпатического отдела;
• Постганглионарные нейроны симпатического отдела, иннервирующие сосуды скелетных мышц и терморегуляторные потовые железы;
• Волокна симпатического отдела, которые иннервируют хромаффинную ткань надпочечников;
• Волокна синокаротидной зоны, которые несут баро- и хеморецепторы. Анатомически это афферентный отдел нервной системы, однако, по своим функциям синокаротидная зона относится к вегетативным образованиям, т. к. контролирует и регулирует процесс дыхания.
Нейромедиатором преганглионарных симпатических, всех парасимпатических и соматических нервных волокон является ацетилхолин.
Историческая справка
Синтезирован в 1867 г A. Baeyer. Впервые его применили в медицинской практике в 1939 г для проведения судорожной терапии при лечении психических заболеваний. Ранее для этой цели широко применяли лептазол, который часто провоцировал развитие переломов во время судорожного припадка. Было заявлено, что при использовании ацетилхолина риск переломов минимален, а эффективность терапии составляет 80%. Однако, энтузиазм к данному виду лечения быстро прошел, поскольку было установлено, что вызываемые ацетилхолином судороги связаны не с его влиянием на мозг, а с аноксией, вследствие паралича сердца. В 1944 г в журнале Archives of Neurology and Psychiatry группа врачей публикует описание клинического состояния, которое возникает после применения ацетилхолина: «…Через несколько секунд после введения ацетилхолина (как можно более быстрого, чтобы избежать его разрушения в крови) больной принимал положение с коленями, прижатыми к груди, согнутыми руками и наклоненной головой. У него начинался приступообразный сильный кашель, иногда с покраснением лица. Отмечалось затруднение при глотании, и были слышны звуки, сопровождавшие усиленную перистальтику. Дыхание было затрудненное и нерегулярное. Кашель прекращался, как только больной ложился на спину.
Через 40 с после введения исчезал пульс и наступала кома. Зрачки расширялись, повышалась активность глубоких рефлексов. Через 45 с развивался опистотонус с коротким апноэ.
…Глубокие рефлексы подавлялись, наступала релаксация, больной оставался неподвижным, кожные покровы были холодными и влажными, серого цвета. Через 90 с покраснение лица свидетельствовало о появлении пульса. Увеличивалась частота дыхания, и приблизительно через 125 с восстанавливалось сознание. Иногда возникало непроизвольное мочеиспускание, но дефекации не было. После проведенного лечения больной предпочитал спокойно лежать в постели. Большинство больных были устойчивы к этому виду лечения».
Синтез и физиологическая роль холинацетилтрансферазы
Ключевой фермент синтеза ацетилхолина, холинацетилтрансфераза, катализирующий синтез медиатора из холина и ацетилкоэнзима А в терминальных окончаниях нервных клеток, образуется в теле нейрона и доставляется в синаптическое окончание путем медленного (1–3 мм/сут) аксонного транспорта. В пресинапсах существует в нескольких изоформах: гидрофильном (сХАТ) и гидрофобном состоянии (мХАТ) Доказано, что сХАТ способна транслоцироваться из цитозоля на синаптические мембраны, обратимо переходя в гидрофобное состояние с образованием ионных связей (ионосвязанная мХАТ). Такая компартментализация обеспечивает большой уровень пластичности холинергических синапсов.
Синтез и депонирование ацетилхолина
Ацетилхолин, уксуснокислый эфир холина, образуется в цитоплазме аксонов из ацетил-КоА и холина — рис.1. Холин поступает в пресинаптическое окончание при помощи натрий-зависимого переносчика, ацетил-КоА поставляется непрерывной работой митохондрий. Ацетилхолин образуется в цитоплазме нервных клеток и поступает в пузырьки, где его концентрация достигает 0,5 М. Создание такой высокой концентрации возможно только за счёт энергетического источника, в качестве которого используется протонный насос. Накопление протонов путём антипорта обеспечивает поглощение пузырьками ацетилхолина.
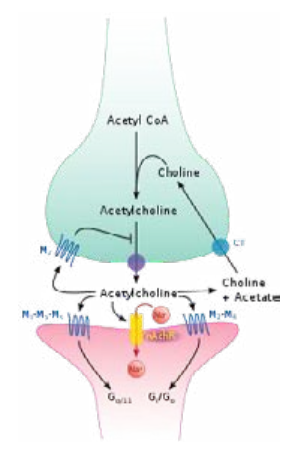
Рис. 1. Синтез и деградация АцХ в холинергическом синапсе
Нейромедиатор хранится в синаптических везикулах, в каждой везикуле содержится примерно 1000–50000 молекул ацетилхолина — 1 квант. Методом молекулярного анализа доказано, что общее число везикул в пресинаптическом окончании достигает 300.000. В мембрану синаптической везикулы встроены трансмембранные белки-ферменты, такие как АДФ-АТФ-транслоказа, АцХ-транслоказа, переносчики двухвалентных ионов металлов. Схематическое строение представлено на рис. 2.
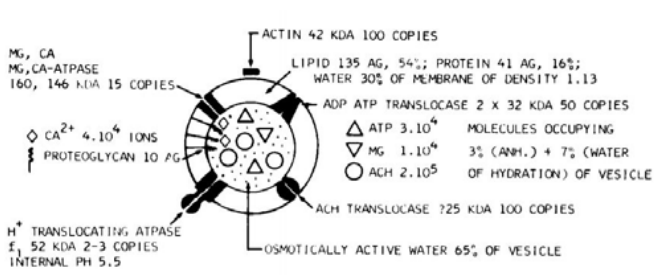
Рис. 2. Схематическое строение синаптической везикулы в пресинаптическом окончании. (V. P. Whittaker)
Процесс передачи сигнала и экзоцитоз нейромедиатора
Потенциал действия достигает пресинаптической мембраны → это вызывает открывание потенциал-управляемых Ca2+-каналов. Ионы Ca2+ проникают из внеклеточного пространства в клетку, активируя специфическую протеинкиназу, фосфорилирующую белки семейства SNARE. Синаптобревин переходит в активированное состояние и начинает выполнять роль своеобразного «крючка» или якоря. Этим якорем везикулы фиксируются к пресинаптической мембране в тех местах, где лежат особые белки — SNAP-25 и синтаксин-1. В последующем эти белки инициируют слияние мембраны везикул с мембраной аксона и выталкивают медиатор в синаптическую щель подобно поршню насоса. При прохождении потенциала действия через пресинаптическую мембрану одновременно опустошаются 2.000–3.000 везикул. Мембрана пузырька сливается с пресинаптической мембраной. В результате её поверхность увеличивается. Далее от неё внутрь нервной клетки отпочковываются мембранные структуры для формирования новых цистерн, а величина поверхности возвращается к обычному состоянию.
☞ Процесс выделения медиатора может быть нарушен под влиянием ботулотоксина (токсин бактерий Clostridium botulinum). Ботулотоксин вызывает протеолиз белков, участвующих в выделении медиатора (SNAP-25, синтаксин, синаптобревин). α-латротоксин — яд паука «черная вдова» связывается с белком SNAP-25 (нейрексином) и вызывает спонтанный массивный экзоцитоз ацетилхолина.
После выделения молекул ацетилхолина из пресинаптических нервных окончаний в синаптическую щель происходит активация холинергических рецепторов (мускаринового и никотинового типов) — см. далее.
Окончание действия
Ацетилхолин гидролизуется в синаптической щели ацетилхолинэстеразой (АХЭ) на ацетат и холин, используемые для ресинтеза. В синапсах (в частности, в концевых пластинках нервно-мышечных синапсов) АХЭ присутствует в виде тетрамера изоформы T (образуемой у человека в результате альтернативного сплайсинга), присоединённого к коллагеноподобному белку, который кодируется отдельным геном COLQ. Мутация этого гена является одной из наиболее распространённых причин наследственной миастении (myasthenia gravis). C помощью коллагеноподобного «хвоста» ацетилхолинэстераза прикрепляется к протеогликану перлекану, входящему в состав базальной пластинки синапса. Перлекан, в свою очередь, присоединяется к дистрогликановому комплексу, встроенному в постсинаптическую мембрану мышечной клетки.
Ацетилхолинэстераза обеспечивает гидролиз 600.000 молекул ацетилхолина в течение 1 минуты. Она имеет 2 активных центра:
• Анионный центр — его формируют карбоксильная группа глутаминовой кислоты, которая несет избыточный отрицательный заряд и триптофан (glu202 и trp286). Этот центр присоединяет катионную головку ацетилхолина и, путем ионной связи, обеспечивает правильную ориентацию молекулы.
• Эстеразный центр — формируется гидроксильной группой серина (ser203), окруженной карбоксильным центром глутаминовой кислоты и имидазольным кольцом гистидина (glu334 и his447). Этот центр формирует ковалентную связь с ацетатной группировкой ацетилхолина, трансформируя тригональную молекулу медиатора в тетрагональный промежуточный продукт.
После образования тетрагонального комплекса с ацетилхолином, фермент отщепляет от него ацетильную группу и подвергается регенерации с освобождением остатка уксусной кислоты. Весь цикл регенерации занимает 150 мС.
В плазме крови инактивация ацетилхолина осуществляется ферментом бутирилхолинэстеразой — сериновой гидролазой с высокой реакционной способностью.
Локализация рецепторов. Особенности строения и функционирования
Холинорецепторами называют молекулы клетки, которые реагируют на медиатор ацетилхолин. Холинорецепторы по своей природе являются гликопротеинами и состоят из нескольких субъединиц. Большинство холинорецепторов клетки являются молчащими (избыточными): в скелетных мышцах количество избыточных рецепторов колеблется от 40 до 99 %, а в гладкомышечных клетках от 90 до 99%.
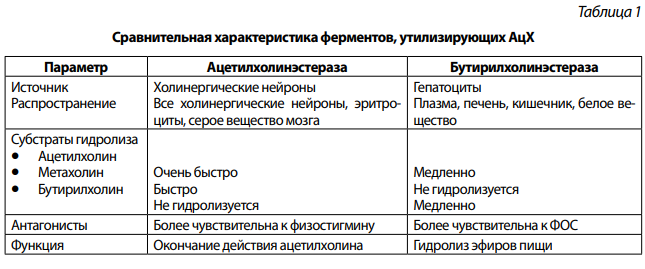
В 1914 г. сэр Henry Dale установил, что в тканях имеются 2 типа холинорецепторов. Рецепторы, которые стимулировались мускарином (ядом мухомора Amanita muscaria) получили название мускариновых (М-холинорецепторов). Рецепторы, которые стимулировал никотин (яд табака Nicotiana tabacum) получили название никотиновых (N-холинорецепторов). Сравнительная характеристика представлена в таблице 2.
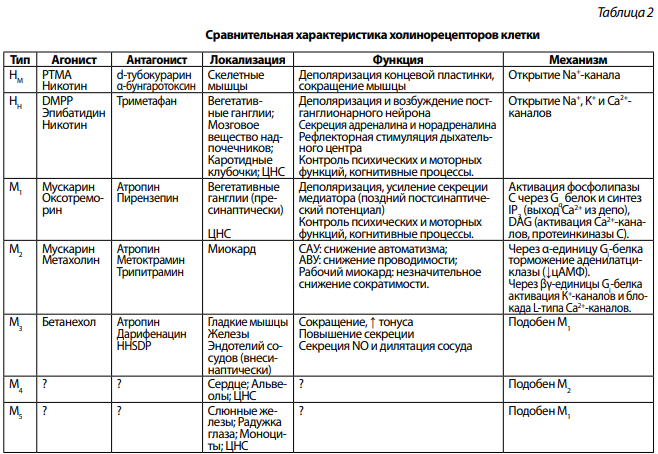
Примечание: α-бунгаротоксин – яд тайваньской гадюки Bungaris multicintus и кобры Naja naja. PTMA – фенилтриметиламмоний; DMPP – диметилфенилпиперазин; HHSDP – гексагидросиладифенол АВУ – атриовентрикулярный узел; САУ – синоатриальный узел
Никотиновые холинорецепторы
Являются пентамерными белками, т. е. состоят из 5 субъединиц и относятся к семейству мембранных рецепторов, связанных с ионными каналами. α-субъединица рецептора содержит активный центр для связывания ацетилхолина и воротные механизмы, которые открывают и закрывают ионный канал. Субъединицы β, γ, δ и ε формируют сам ионный канал в мембране, который пропускает ионы натрия. В состав рецептора всегда входят 2α-субъединицы и 3 канальных субъединицы белка. Методом молекулярного клонирования было установлено, что имеется 2 активных центра N-холинорецепторов (поэтому активация рецептора происходит только после того, как с ним свяжется 2 молекулы ацетилхолина):
• NН-холинорецепторы — располагаются в мембранах нейронов, состоят из 2α и 3β субъединиц.
• NМ-холинорецепторы — располагаются в скелетных мышцах, состоят из 2α-субъединиц и канального комплекса β,γ,ε.
Мускариновые холинорецепторы
Относятся к семейству мембранных рецепторов, связанных с G-белками. Методом молекулярного клонирования было установлено, что имеется 5 типов М-холинорецепторов, которые могут быть объединены в 2 группы:
• Семейство М1, М3, М5-холинорецепторов — связано с Gq-белком и передает сигнал на фосфолипазу С, которая гидролизует фосфатидилинозитол бифосфат (PIP2) до инозитол трифосфата (IP3) и диацилглицерола (DAG). В дальнейшем IP3 обеспечивает мобилизацию ионов кальция из внутриклеточных депо и активацию кальций-зависимых ферментов, а DAG активирует протеинкиназу С, которая фосфорилирует ряд внутриклеточных белков, изменяя их активность.
• Семейство М2 и М4-рецепторов связано с Gi-белками, которые снижают активность аденилатциклазы, а через βγ-субъединицы эти белки активируют К+-каналы и блокируют работу Са2+-каналов клетки.
Общая характеристика адренергических синапсов. Локализация
Адренорецепторами называют молекулы клетки, которые реагируют на нейромедиатор норадреналин, гормон адреналин и дофамин. Впервые мысль о возможном существовании нескольких типов адренорецепторов была выдвинута английским фармакологом Ahlquist в 1948 г. В настоящее время адренорецепторы подразделяют на 2 класса:
α-адренорецепторы — этот класс рецепторов опосредует сокращение гладких мышц под влиянием норадреналина. Обнаружено 2 типа α-адренорецепторов (α1 и α2), каждый из которых имеет по крайней мере 3 подтипа.
β-адренорецепторы — этот класс рецепторов опосредует расслабление гладких мышц под влиянием норадреналина. Обнаружено 3 типа β-адренорецепторов (β1, β2, β3).
Адренергическими являются:
• Нейроны ЦНС;
• Постганглионарные волокна симпатического отдела вегетативной нервной системы Все типы адренорецепторов являются семейством мембранных рецепторов, связанных с G-белками (GPCR, G-protein-coupled receptors).
Синтез и депонирование нейромедиатора
В отличие от холинергического синапса, адренергические проводники приближаясь к исполнительному органу образуют тонкую сеть волокон с варикозными утолщениями и синапсы формирует не единственное нервное окончание, а множество варикозных утолщений. Источниками синтеза норадреналина являются аминокислоты фенилаланин и тирозин. Превращение фенилаланина в тирозин является неспецифическим процессом и протекает в печени под влиянием фенилаланин-гидроксилазы. Тирозин поступает через мембрану варикозного утолщения в цитоплазму при участии специального переносчика, путем сопряжённого с ионами Na+ транспорта. Затем в цитоплазме тирозин подвергается вначале гидроксилированию в диоксифенилаланин (ДОФА) ферментом тирозингидроксилазой, а затем де-карбоксилируется до дофамина ферментом ДОФА-декарбоксилазой. Стадией, которая регулирует весь процесс синтеза является гидроксилирование тирозина. Существуют соединения, которые блокируют тирозин-гидроксилазу и, поэтому, нарушают синтез медиатора в целом. Примером такого соединения является α-метилтирозин (метирозин). Дофамин при помощи специального переносчика транспортируется внутрь везикул в обмен на 2 протона или ион Mg2+. Работа данного переносчика может быть блокирована резерпиновыми алкалоидами. В дофаминергических нейронах дальнейший синтез медиатора на этом прекращается.
В норадренергических нейронах везикулы содержат фермент дофамин-β-гидроксилазу, который выполняет гидроксилирование молекулы дофамина и переводит ее в норадреналин. Хромаффинная ткань надпочечников проводит дополнительную реакцию N-метилирования норадреналина при помощи N-метилтрансферазы и синтезирует из норадреналина адреналин (рис.3).
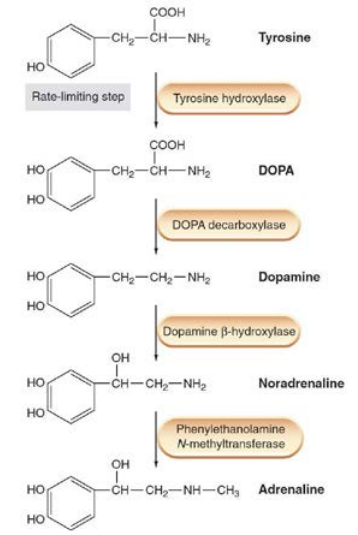
Рис. 3. Этапы синтеза норадреналина и адреналина
В везикулах норадреналин упакован в плотные гранулы совместно с АТФ, витамином С, ферментом дофамин-β-гидроксилазой и особым белком хромогранином. Выделяют 2 типа везикул:
• везикулы с гранулами высокой плотности и низкой активностью дофамин-β-гидроксилазы — являются стабильным депо норадреналина;
• везикулы с гранулами низкой плотности и высокой активностью дофамин-β-гидроксилазы. Они являются лабильным депо норадреналина и обеспечивают процесс его секреции в синапс в обычных условиях.
Вещества из группы симпатомиметиков — тирамин, амфетамин могут проникать внутрь везикул и вытеснять из них норадреналин в синаптическую щель.
Процесс передачи сигнала и экзоцитоз нейромедиатора
В целом, механизм одинаков с холинергическими синапсами: потенциал действия достигает пресинаптической мембраны → это вызывает открывание потенциал-управляемых Ca2+-каналов. Ионы Ca2+ проникают из внеклеточного пространства в клетку, активируя специфическую протеинкиназу, фосфорилирующую белки семейства SNARE. Синаптобревин переходит в активированное состояние и начинает выполнять роль своеобразного «крючка» или якоря. Этим якорем везикулы фиксируются к пресинаптической мембране в тех местах, где лежат особые белки — SNAP-25 и синтаксин-1. В последующем эти белки инициируют слияние мембраны везикул с мембраной аксона и выталкивают медиатор в синаптическую щель подобно поршню насоса.
Развитие биологического действия. Эффекты стимуляции рецепторов.
Норадреналин, который выделяется из варикозных утолщений в синаптическую щель путем диффузии поступает к постсинаптической мембране и активирует α1 и β1-типы адренорецепторов. Часть норадреналина воздействует на пресинаптические α2- и β2-адренорецепторы и по принципу отрицательной обратной связи тормозит дальнейшую секрецию медиатора.
Гормон надпочечников адреналин воздействует в основном на внесинаптические α2 и β2-адренорецепторы.
α1-адренорецепторы посредством Gq-белка передают сигнал на несколько эффекторных систем:
• Фосфолипазу С, которая гидролизует фосфатидилинозитол бифосфат (PIP2) до инозитов трифосфата (IP3) и диацилглицерола (DAG). Молекулы IP3 вызывают выход ионов Са2+ из внутриклеточного депо и активируют зависимые от Са2+ ферменты (кальмодулин). DAG — обеспечивает активацию протеинкиназы С и фосфорилирование внутриклеточных белков, а также открывает Са2+-каналы мембраны. Под влиянием ионов Са2+ и активного кальмодулина происходит дефосфорилирование киназы лёгких цепей миозина, которая переходит в активную нефосфорилированную форму, при этом начинают фосфорилироваться легкие цепи миозина и запускается процесс сокращения гладкомышечных клеток.
• Фосфолипазу А2, которая гидролизует фосфолипиды с выделение арахидоновой кислоты. В последующем арахидоновая кислота трансформируется в простагландины и лейкотриены.
• Фосфолипазу D, которая гидролизует фосфатидилхолин до фосфатидной кислоты. Молекулы фосфатидной кислоты вызывают выделение ионов Са2+ из депо, активируют АДФ-рибозилирующий фактор.
• Показана возможность активации G-белками Са2+-каналов клетки.
α2-адренорецепторы посредством Gi-белка также передают сигнал на несколько эффекторных систем:
Gi-белок снижает активность аденилатциклазы и уменьшает синтез цАМФ в клетке. В итоге, активность зависимых от цАМФ протеинкиназ падает.
Через G0-белки тормозятся Са2+-каналы L- и N-типов.
βγ-субъединицы G-белка активируют К+-каналы мембраны.
Относительно недавно было обнаружено, что βγ-субъединицы Gi-белка могут стимулировать митоген-активирующие протеинкиназы (МАРК), которые обеспечивают процессы деления и размножения стволовых клеток.
β-адренорецепторы всех типов реализуют свое действие через Gs-белки. α-субъединицы этого белка активируют аденилатциклазу, которая обеспечивает синтез в клетке цАМФ из АТФ и активацию цАМФ зависимой протеинкиназы А. βγ-субъединицы Gs-белка активируют Са2+каналы L-типа. Под влиянием цАМФ-зависимой протеинкиназы А происходит фосфорилирование киназы лёгких цепей миозина, и она переходит в неактивную форму, не способную фосфорилировать легкие цепи миозина. Процесс фосфорилирования легких цепей прекращается, и гладкомышечная клетка расслабляется.
Локализация адренорецепторов
Сравнительная характеристика адренорецепторов приведена в таблице 3.
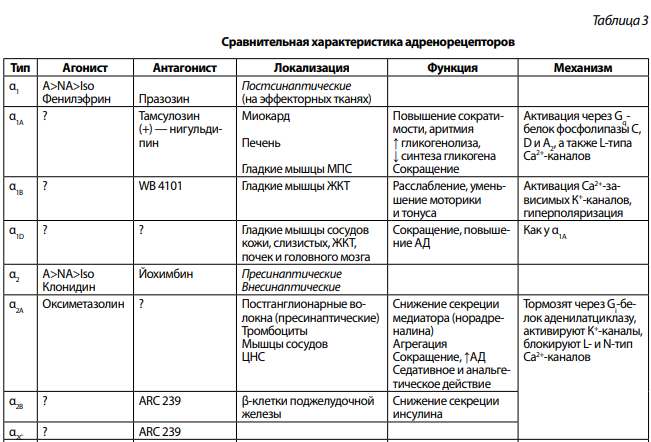
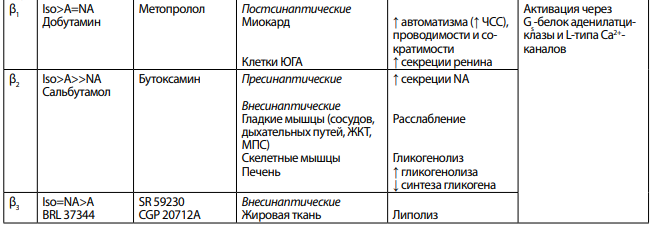
Примечание: A — адреналин, NA — норадреналин, Iso — изопреналин, МПС — мочеполовая система.
Окончание действия
После диссоциации медиатора от рецептора происходит его инактивация с участием 3 процессов:
• Нейрональный захват (захват-1) — представляет собой транспорт медиатора через пресинаптическую мембрану обратно в варикозное утолщение, совместно с ионами Na+ специальным переносчиком. В последующем, медиатор вновь включается в гранулы везикул при помощи Mg2+/катехол-АТФазы. Обратному нейрональному захвату подвергается 80 % медиатора. Такое экономичное отношение связано с тем, что синтез норадреналина и адреналина является весьма затратным для организма процессом и требует значительных расходов аминокислот и энергии.
• Экстранейрональный захват (захват-2) — связан с транспортом медиатора в нейроглию, фибробласты, миокард, эндотелий, гладкие мышцы при помощи специального переносчика. Экстранейрональному захвату подвергается 10 % медиатора. Это основной путь сохранения адреналина в надпочечниках.
• Метаболическая инактивация под влиянием моноаминооксидазы (МАО) или катехол-О-метил трансферазы (КОМТ). Процессу инактивации подвергается только 10 % оставшегося медиатора.
- МАО локализуется на внешней мембране митохондрий, под влиянием этого фермента происходит окислительное дезаминирование катехоламинов с образованием альдегидов. В последующем эти альдегиды подвергаются окислению НАД-зависимой альдегиддегидрогеназой в дигидроксиминдальную кислоту или восстанавливаются редуктазой до гликолей. Существует 2 изоформы данного фермента (таблица 4)

- КОМТ располагается в цитоплазме и катализирует орто-метилирование ароматического кольца катехоламинов (только при наличии гидроксогрупп в 3-ем и 4-ом положениях кольца). Получающиеся метилированные продукты в 200–2000 раз менее активны, чем норадреналин.
Как правило метаболизм катехоламинов осуществляется последовательно обоими ферментами, но может превалировать какой-либо один, например при блокировании МАО специфическими ингибиторами (рис.4). Конечным продуктом метаболизма является ванилилминдальная кислота.
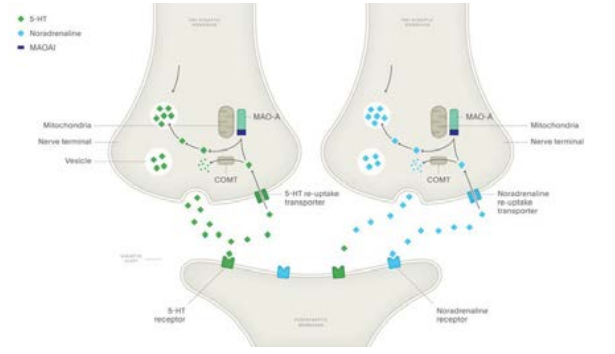
Рис. 4. Механизм действия блокаторов МАО-А и «шунтирование» метаболизма
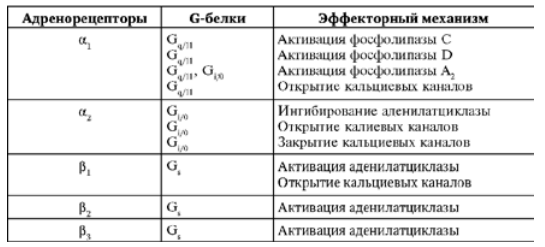
Рис.4. Механизмы действия адренорецепторов
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
CONFLICT OF INTEREST
The authors declare no conflict of interest.


