Для индукции овуляции и спермиации у производителей осетровых рыб в последние годы стали широко использоваться гипофизы карповых рыб и сурфагон, являющийся синтетическим аналогом гонадолиберина. В качестве ингибитора дофамина предлагают использовать содержащие резерпин алкалоиды раувольфии в виде препарата раунатина [4]. Эффективность синтетического гонадолиберина для индукции овуляции у стерляди установлена еще в 1986 году при введении его самкам в дозе 100 и 300 мкг/кг [11].
Изучение механизмов гормональной стимуляции овуляции ооцитов у осетровых рыб выявило важную роль прогестерона, оптимальная концентрация которого при инкубации ин витро составляет 30 нг/мл [6]. Гормональная стимуляция созревания гамет у самок и самцов стерляди сурфагоном и препаратом гипофиза приводит к характерной динамике уровня кортизола и половых стероидных гормонов (тестостерон, 11-кетотестостерона и 17,20β,21-тригидроксипрегнен-3-она) [1]. Исследование содержания половых стероидов и кортизола в культуральной среде при инкубации тканей самок и самцов стерляди после гормональной стимуляции сурфагоном подтверждает их важную роль в регуляции заключительных этапов созревания гамет [2].
Высокий уровень дофамина как физиологического антагониста гонадолиберина может препятствовать наступлению овуляции или спермиации у рыб при попытках стимулировать созревание гамет синтетическими аналогами гонадотропин-рилизинг-гормона [10]. Ингибирующий эффект дофамина на образование гонадолиберина нейронами гипоталамуса реализуется через рецепторы подтипа D2 [9].
В последние годы доказана эффективность для индуцирования овуляции у стерляди трех новых синтетических аналогов гонадолиберина, применяемых в комбинации с антагонистами дофамина [12].
Синтетические аналоги гонадолиберина входят в современные схемы гормональной стимуляции производителей осетровых рыб при их искусственном воспроизводстве и успешно применяются [7]. Однако эффективность сурфагона в комбинации с раунатином в качестве замены препаратов гипофиза в схемах стимуляции овуляции ооцитов у впервые нерестующей стерляди, которая широко используется для получения пищевой икры, изучена недостаточно.
Целью исследований явилось определение эффективности гормональной стимуляции впервые нерестующих самок стерляди, выращенных в условиях регулируемого температурного режима, при частичной или полной замене препарата карпового гипофиза сурфагоном и раунатином.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исследования выполняли в 2016 году на базе ТОО Caspian Royal Fish (г. Атырау, Казахстан) при получении овулировавшей икры для пищевых целей от впервые нерестующих самок стерляди в возрасте 2,4 года. Стерлядь была выращена в установке замкнутого водоснабжения (УЗВ) в бассейнах объемом 37 м³ при температуре 21–22 °C. Для выявления самок в группах выращиваемых рыб и определения стадии зрелости гонад (СЗГ) выполняли ультразвуковое исследование. Самок стерляди с IV СЗГ отправляли в зимовальный цех, постепенно понижая температуры воды в транспортировочных емкостях. Искусственную зимовку самок осуществляли 2,5–3 месяца на прямоточном водоснабжении при температуре в пределах от +6 до +7 °C. Нерестовую кампанию проводили в установке замкнутого водоснабжения (УЗВ) с регулируемым температурным режимом. Cамок стерляди переводили в состояние готовности к нересту путем постепенного повышения температуры воды в бассейне до нерестового уровня.
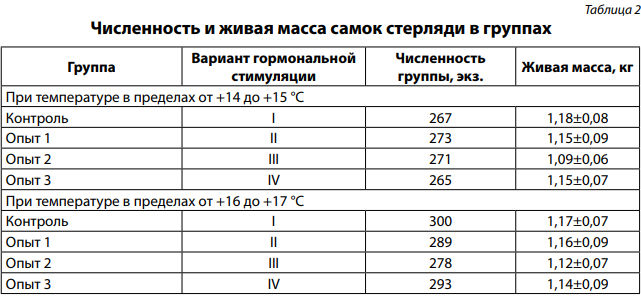
Эксперимент по гормональной стимуляции самок стерляди для получения овулировавшей икры проводили в двух температурных диапазонах: при температуре +14–15 и +16–17 °C. Изучали четыре варианта гормональной стимуляции самок стерляди. Все варианты включали в себя предварительную и разрешающую инъекции препаратов. Вариант I (контроль) включал в себя воздействие только карповым гипофизом, опытные варианты предусматривали его частичную (II вариант) или полную (III и IV варианты) замену сурфагоном и раунатином (табл. 1).

Численность самок в группах контроля и опыта была в пределах 265–300 экз. Живая масса самок стерляди в группах опыта и контроля достоверно не различалась (табл. 2).
Получение овулировавшей икры выполняли прижизненно методом надрезания яйцевода [5]. Достоверность различий между группами опыта и контроля оценивали по критериям хи-квадрат и Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
При температуре в пределах от +14 до +15 °C в группе контроля наблюдалось созревание 79,78% самок при времени созревания 33,2±0,5 часа. Во всех опытных группах доля созревших самок оказалась достоверно снижена, а время созревания — более высоким (табл. 3). Наименьшая величина доли созревших самок отмечена при использовании III варианта гормональной стимуляции (на 20,0% ниже, чем в контроле). Доля созревших самок при использовании II и IV вариантов гормональной стимуляции оказалась на 9,82 и 9,97% меньше, чем в группе контроля.
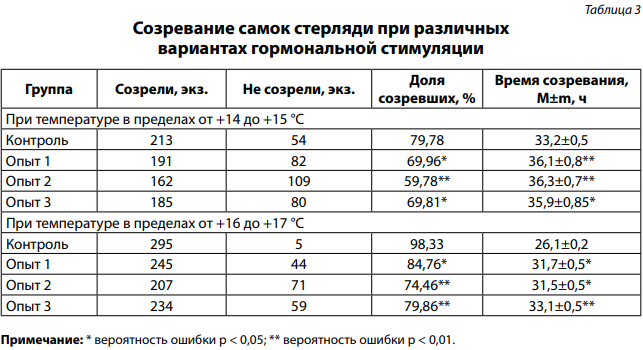
Проведение гормональной стимуляции при более высокой температуре (в пределах от +16 до +17 °C) привело к созреванию в группе контроля 98,33% самок при более коротком времени созревания (26,1±0,2 часа). Как и в эксперименте при меньшей температуре воды, в опытных группах доля созревших самок оказалась достоверно меньше, а время созревания — большим (табл. 3). Наименьшая доля созревших самок выявлена при использовании III варианта гормональной стимуляции (на 23,87% ниже, чем в контроле). Доля созревших самок при использовании II и IV вариантов гормональной стимуляции оказалась на 13,57 и 18,47% меньше, чем в контрольной группе.
Таким образом, частичная или полная замена карпового гипофиза сурфагоном и раунатином при гормональной стимуляции впервые нерестующих самок стерляди, выращенных в условиях регулируемого температурного режима, приводит к некоторому снижению эффективности воздействия. Это подтверждается достоверным уменьшением во всех опытных группах доли самок, от которых получена овулировавшая икра. Уменьшение доли созревших самок во всех опытных группах наблюдалось как при температуре воды в пределах от +14 до +15 °C, так и при температуре в пределах от +16 до +17 °C. Сниженная эффективность гормональной стимуляции в опытных группах самок стерляди подтверждается также достоверным увеличением времени созревания.
Наиболее эффективным среди изученных опытных вариантов гормональной стимуляции впервые нерестующих самок стерляди оказался II вариант, предусматривающий частичную замену карпового гипофиза в процедуре воздействия. Выполненные ранее исследования гормональной стимуляции созревания гамет у производителей стерляди из естественных водоемов (Нижне-Иртышское стадо) сурфагоном показали бóльшую эффективность двукратного введения препарата по сравнению с однократным. Разрешающая доза 15 мкг/кг при температуре воды 16,2 и 18,0 °C была достаточно эффективной [8]. Повышение эффективности гормональной стимуляции созревания производителей стерляди может быть достигнуто при использовании трехкратного инъецирования сурфагона [3], однако недостатками многократного инъецирования являются стрессирование рыбы и повышение трудоемкости процедуры гормональной стимуляции.
ВЫВОДЫ
1. Частичная или полная замена карпового гипофиза сурфагоном и раунатином при гормональной стимуляции впервые нерестующих самок стерляди, выращенных в условиях регулируемого температурного режима, приводит к снижению эффективности воздействия.
2. Наиболее эффективной опытной схемой гормональной стимуляции впервые нерестующих самок стерляди оказался II вариант, предусматривающий лишь частичную замену карпового гипофиза сурфагоном и раунатином в процедуре воздействия.


