Актуальность
По данным Американской ассоциации инсульта частота неразорвавшихся аневризм составляет 2,8 % (2,0–3,9 %) в популяции. Отношение разорвавшихся к неразорвавшимся аневризмам колеблется от 5:3 до 5:6 (приблизительно 1:1), следовательно, практически половина церебральных аневризм рано или поздно разрываются [14, 1146; 16, 9].
В работе ISUIA, посвященной проблеме хирургического лечения неразорвавшихся аневризм, выявлено, что факторами риска разрыва аневризмы являются ее размер и локализация, тогда как возраст пациентов не влияет на частоту разрыва аневризмы. Установлен высокий риск повторных кровотечений из аневризм развилки основной артерии, устья ЗСА и офтальмического сегмента ВСА [17, 107].
Для крупных и гигантских аневризм характерны геморрагический тип течения — до 70 %, псевдотуморозный тип — до 20 %, бессимптомный тип — до 10 % наблюдений [1, 29; 2, 13; 3, 60]. Некоторыми авторами выделяется эмболический тип течения, проявляющийся явлениями ишемии в бассейне, соответствующем несущей аневризму, артерии с частотой до 5 % всех крупных и гигантских аневризм [4, 82; 12, 904].
Потокоотклоняющие стенты приводят к закрытию аневризмы спустя определенный период, спрогнозировать который пока не представляется возможным. Значимая стагнация контраста в аневризме может быть выявлена уже на контрольных снимках после операции, а степень окклюзии аневризмы продолжает увеличиваться в период между 6 и 12 месяцами с момента установки стента [5, 10; 7, 29; 13, 935]. В настоящее время остается недостаточно изученным вопрос о сохраняющихся неврологических нарушениях даже после значительного уменьшения размеров аневризмы.
Материалы и методы исследования
Проведено исследование 176 пациентов со 179 аневризмами сложной конфигурации: аневризмы крупных и гигантских размеров, широкая шейка, наличие ветви от шейки аневризмы. Срок наблюдений — с января 2010 по декабрь 2017 года.
Клинико-инструментальный комплекс включал неврологический осмотр с оценкой по таким шкалам, как: Монреальская шкала оценки когнитивных функций (MoCa), шкала инсульта национального института здоровья (NIHSS), модифицированная шкала Рэнкин (mRS), опросник по амблиопии и косоглазию (ASQE), шкала качества жизни EQ-5D-5L© с визуально аналоговой шкалой (EQ VAS), международная классификация функционирования (МКФ); заключение нейроофтальмолога с использованием периметрии, оценкой состояния глазного дна; селективную церебральную ангиографию (ЦАГ), АДФ-индуцированную агрегатометрию до назначения дезагрегантной терапии, через 3 дня от ее начала, через 6 и 12 месяцев. Степень окклюзии аневризмы оценивалась по шкале Cekirge и Saatci, являющейся модификацией классификации типа окклюзии аневризм Raymond и Ray, позволяющей оценить изменения потока в аневризме непосредственно сразу после проведения эндоваскулярного лечения и в отдаленном периоде [8, 20].
Двойная дезагрегантная терапия проводилась Клопидогрелем (75 мг) и ацетилсалициловой кислотой (100 мг в сутки).
Результаты исследования и обсуждение
В основной группе (число наблюдений n = 85, число аневризм n = 85) через 2 года после установки потокоотклоняющих стентов в 63 наблюдениях (74,1 %) отмечено значимое уменьшение размеров с сохранением боковых ветвей (класс 1B по классификации Cekirge и Saatci) в 19 случаях (22,4 %) достигнуто стойкое ремоделирование аневризмы без продолженного роста (класс 5), в 2 случаях (2,3 %) отмечался продолженный рост аневризмы. Летальный исход в одном наблюдении (1,2 %) был связан с разрывом аневризмы гигантских размеров на седьмые сутки от начала проведенного эндоваскулярного лечения.
В группе сравнения (число наблюдений n = 91, число аневризм n = 94) через 2 года после эмболизации микроспиралями со стент-ассистенцией 72 аневризм (76,2 %) были полностью окклюзированы (1 класс). Заполнение пришеечной части аневризмы без продолженного роста (2 класс) было выявлено в 17 аневризмах (17,7 %), в пяим наблюдениях (4,9 %) отмечался продолженный рост аневризмы. Летальный исход в одном наблюдении (1,2 %) был связан с тромбозом ассистирующего стента, установленного в a.basilaris, развившимся в первые сутки, несмотря на проведение системной тромболитической терапии.
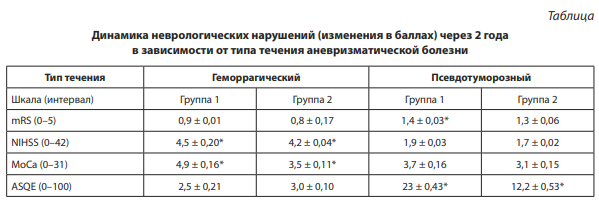
При псевдотуморозном типе течения уменьшение глазодвигательных нарушений и птоза отмечено в 18 наблюдениях (21,9 %), из них в четырех случаях с увеличением остроты зрения на стороне аневризмы. В четырех (4,8 %) наблюдениях значимого улучшения не отмечалось, при этом в двух наблюдениях по данным селективной ЦАГ отмечалась стагнация контраста в аневризме сразу после операции (класс 4A) и значимое уменьшение ее размеров на момент контроля через 12 месяцев (класс 5).
В трех наблюдениях без клинического улучшения при положительном ангиографическом результате давность заболевания до операции превышала 12 месяцев, в одном из случаев сохранился кальцинированный тромб, сохранивший свое объемное воздействие.
Отрицательная динамика очаговой и общемозговой симптоматики отмечалась в раннем послеоперационном периоде в четырех наблюдениях (4,8 %) в основной группе и 14 наблюдениях (14,8 %) в группе сравнения. Нарастание офтальмоплегии и возобновление головной боли при аневризмах крупных и гигантских размеров как после установки потокотклоняющих стентов, так и после эмболизации микроспиралями со стент-ассистенцией было расценено как следствие формирования зоны перианевризматического отека, в связи с чем была рекомендована терапия глюкокортикостероидами. Во всех случаях данные нарушения полностью регрессировали к моменту второго контроля (12 месяцев).
Развитие гиперплазии эндотелия было выявлено у 4 пациентов (5 %), что сопоставимо с данными, опубликованными в зарубежной литературе [10, 864; 11,5; 9, 930]. У одной пациентки гиперплазия была выявлена уже через полгода от момента установки стента, но оставалась бессимптомной в течение полутора лет. После чего отметила резкое снижение зрения на левый глаз и транзиторные приступы при сильном физическом напряжении в виде нечеткости речи и слабости в правой руке длительностью до 3–5 минут, в связи с чем была проведена ЦАГ, на которой было выявлено отсутствие заполнения a.ophtalmica и полное ремоделирование стенки офтальмического сегмента ВСА (1С класс окклюзии по Cekirge и Saatci). Гиперплазия от дистального участка потокоотклоняющего стента распространилась на область М1сегмента левой СМА и привела к стенозу более 50 % от просвета сосуда и обеднению кровотока в соответствующем бассейне. Была выявлена также выраженная анастомотическая сеть на уровне гиперплазии, что позволило продолжить наблюдение с сохранением двойной дезагрегантной терапии. На момент контроля через два года от момента операции жалоб на снижение зрения и преходящую слабость в руке с нечеткостью речи не отмечалось. В остальных трех наблюдениях гиперплазия оставалась бессимптомной в течение всего периода наблюдения.
В ближайшем послеоперационном периоде (через 6 месяцев) по всем шкалам выявлена положительная динамика. При псевдотуморозном типе течения выявлена наиболее выраженная положительная динамика по опроснику амблиопии и косоглазия, оценивающему качество жизни пациентов со зрительными нарушениями. Увеличение среднего балла по ASQE через 6 месяцев в среднем составило в основной группе 19 баллов (p = 0,001) и 8,2 балла (p = 0,031) в группе сравнения.
В отдаленном послеоперационном периоде (через два года) продолжается увеличение среднего значения по всем шкалам (таблица), что свидетельствует о высоком профиле безопасности применяемых методик в отдаленном периоде.
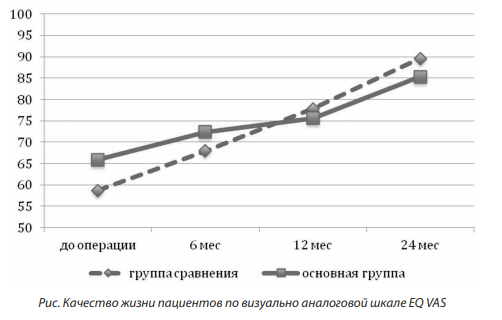
В процессе наблюдения пациентов обращали на себя внимание частые высказывания об опасениях возможного отсутствия окклюзии аневризмы на момент проводимых контрольных исследований. Ожидание негативного результата как сохраняющегося риска для жизни приводит к формированию стойкой тревожной оценки перспектив и значимо снижает качество жизни пациентов. Среднее значение EQ VAS до операции в группе сравнения составило 58,7 ± 16,3 балла, в основной группе — 65,9 ± 18,4 балла. Через год наблюдения пациентов среднее значение EQ VAS увеличилось до 75,5 ± 15,8 и 77,8 ± 13,3 балла соответственно. Через два года среднее значение EQ VAS составило 85,3 ± 11,4 мм в основной группе и 89,6 ± 12,2 мм в группе сравнения. Более выраженная положительная динамика качества жизни (увеличение среднего значения на 9,8 балла в основной группе и 11,8 балла, p < 0,05) на втором году наблюдения может быть связана с положительными результатами лечения в большинстве случаев — более 70 % наблюдений имели положительный результат как в основной группе, так и на втором году наблюдения (рисунок).
Положительная динамика по МКФ в отдаленном периоде отмечена в отношении мобильности пациентов в виде полного регресса нарушений ходьбы (по различным поверхностям у 17 %), восстановления точных движений кисти у 9 % и значимого улучшения с переходом в более легкую категорию у 6 % и улучшение самообcлуживания (самостоятельно смогли одеться на 22 % больше респондентов) привели к значимой бытовой адаптации (включая приобретение товаров и приготовление пищи) более чем у 20 % наблюдений, проблема межличностного взаимодействия более не отмечались у 6 % пациентов из 12 % имеющих таковые до операции.
Заключение
Установка потокотклоняющих стентов является достаточно безопасным методом лечения аневризм сложной конфигурации в ближайшем и отдаленном периодах и позволяет достичь регресса неврологических нарушений при псевдотуморозном типе течения аневризматической болезни. Применение потокотклоняющих стентов позволяет достигнуть высокого уровня качества жизни пациентов (по данным опросника EQ-5D-5L©, ASQE).
Положительная динамика неврологических нарушений после установки потокоотклоняющих стентов приводит к улучшению в доменах активности и участия МКФ: мобильности, самообcлуживания, бытовой адаптации и межличностных взаимодействий.


