Количество онкологических пациентов, которые сталкиваются на различных этапах своей болезни с проблемой развития метастатического поражения головного мозга [1], составляет 20–40 %. В частности, данная патология ежегодно выявляется у 70 тысяч россиян [2]. Рак молочный железы — одна из превалирующих причин развития метастатического поражения головного мозга после рака легких [3]. Возможность бессимптомного течения процесса ведет к выявлению метастазов в головном мозге у менее чем 30 % больных раком молочной железы, однако данные аутопсии показывают, что частота их развития у данной группы пациентов может достигать 40 % [4, 5].
Конечно, развитие метастатического поражения головного мозга является одним из наиболее неблагоприятных факторов прогноза и способно существенно лимитировать продолжительность жизни пациентов, среднее значение которой варьируется от 2,3 месяца для больных со статусом RPA III до 7,1 для RPA I, со значением 4,2 для RPA II (в соответствии с системой RPA (Recursive Partitioning Analysis), базирующейся на индексе Карновского и возрасте пациента, наличии или отсутствии активности первичного опухолевого процесса и экстракраниальных проявлений болезни) [6, 7]. Более совершенная и адресная система GPA (Graded Prognostic Assessment) основана не только на возрасте и индексе Карновского больного, но и на статусах рецепторов эстрогена и прогестерона и Her-2/neu опухоли молочной железы. В зависимости от комбинации этих факторов средняя продолжительность жизни больных с метастазами рака молочной железы в головном мозге составляет от 3,4 до 25,3 месяца [8].
Непрестанное совершенствование хирургических методик, лучевой терапии и лекарственного лечения больных с метастатическим поражением головного мозга благоприятно влияет на продолжительность жизни таких пациентов. Российское исследование, в рамках которого больным с метастазами рака молочной железы в головном мозге проводили облучение всего объема головного мозга с последующей стереотаксической радиотерапией отдельных очагов с конкурентным проведением химиотерапии Капецитабином, показало высокие результаты продолжительности жизни со средними значениями от 15,1 до 22 месяцев в зависимости от последовательности проведения этапов лечения [9].
Более 90 % больных, включенных в исследование, представляли II группу прогноза RPA (ожидаемая продолжительность жизни — 4,2 месяца), все они имели Her-2/neuнегативный статус опухоли (II и III группы прогноза GPA: ожидаемая продолжительность жизни — 7,7–15,1 месяца). Интенсификация лечения больных с метастазами в головном мозге наряду с увеличением показателей локального контроля метастазов и продолжительности жизни пациентов может также способствовать увеличению риска развития лучевых повреждений за счет суммирования негативных эффектов, оказываемых воздействием ионизирующего излучения на здоровые ткани головного мозга на разных этапах лучевой терапии.
Одновременная химиотерапия, большое количество линий и курсов лекарственного лечения в анамнезе могут оказывать дополнительное стимулирующее воздействие на процесс развития постлучевых повреждений [10].
Одно из таких осложнений — постлучевой некроз — развивается в здоровых тканях головного мозга, окружающих подвергнутый лучевой терапии метастаз. Данное осложнение чаще развивается в течение 6–24 месяцев после проведения лучевой терапии [11], а частота его развития после стереотаксической радиохирургии может достигать 50 % [12]. Однако она неуклонно снижается в связи с совершенствованием радиотерапевтического оборудования. Факторами, определяющими частоту его развития, являются объем облучения (то есть масштаб метастаза) и размеры разовой (РОД) и суммарной (СОД) очаговых доз [13, 14]. Нередко постлучевой некроз протекает абсолютно бессимптомно и выявляется лишь по данным радиологических исследований [15].
Дифференцировать постлучевой некроз и продолженный рост или рецидив метастаза — сложная задача, и однозначный ответ может быть получен лишь при проведении морфологического исследования материала, полученного из зоны изменений хирургическим путем. Учитывая тот факт, что хирургическое вмешательство не всегда может быть выполнено в подобных клинических ситуациях (или его выполнение может быть нецелесообразно), анализ данных таких исследований, как МРТ с внутривенным контрастированием, диффузионно-взвешенная МРТ, МРТ-перфузия, МРТ-спектроскопия и ПЭТ-КТ, и оценка этих исследований в динамике, а также анализ клинической картины и нюансов проведенной лучевой терапии могут способствовать установлению верного диагноза.
Приоритетным радиологическим методом диагностики метастатических изменений в веществе головного мозга является МРТ с внутривенным контрастированием. Данный метод позволяет предположить факт развития постлучевого некроза после проведенного лечения, а также определяет дальнейшую диагностическую тактику (МРТ/КТ-перфузия, ПЭТ/КТ и т. д.) для дифференциации некроза и роста опухоли.
Высокими чувствительностью и специфичностью в диагностике постлучевого некроза обладает ПЭТ-КТ, тем не менее, одних только её данных недостаточно для однозначной постановки диагноза. Предметом современных исследований является выбор оптимального радиофармпрепарата ( 18F-фтордезоксиглюкозы, 18F-флюоротимидина, меченых аминокислот) [16, 17].
Метаанализ 2012 года демонстрирует высокие показатели чувствительности и специфичности различных радиологических и радиоизотопных методов диагностики постлучевого некроза [18] (таблица).
Перспективным решением проблемы дифференциальной диагностики постлучевого некроза и жизнеспособной опухолевой ткани является применение «карт оценки ответа на лечение» (TRAMs, treatment response assessment maps) [27]. Морфологическое исследование удалённых метастазов показало, что области «аккумуляции» контрастного препарата, определяющиеся через 60 и более минут после его введения, соответствуют неопухолевым изменениям, а области «вымывания» (при тех же сроках оценки) — активной опухолевой ткани — со 100 %-ной чувствительностью и 92 %-ной специфичностью для живой опухоли.
Приведенный ниже клинический случай является примером сложности дифференциальной диагностики постлучевого некроза, требующей мультидисциплинарного подхода во избежание совершения клинически значимой ошибки.
Больная Б. Возраст на момент выявления заболевания — 30 лет.
Диагноз: рак левой молочной железы, отёчная форма, метастатическое поражение лимфатических узлов левых подмышечной и шейно-надподключичных областей, T4N3М0, IIIc стадия, состояние после химиотерапии. Прогрессирование заболевания: метастатическое поражение костей скелета, головного мозга, состояние после комплексного лечения. Рецидив заболевания в левой молочной железе, появление нового метастаза в головном мозге, состояние после комплексного лечения. Прогрессирование заболевания: рост опухоли в левой молочной железе, состояние после комплексного лечения. Прогрессирование заболевания: появление новых метастазов в веществе головного мозга.
Гистологическое исследование (core-биопсия): инвазивный рак неспецифического типа, G3. РЭ — 0 баллов из 8, РП — 0 баллов из 8, Her 2/neu — 3+, Ki67 — 65 %.
Генетическое исследование: наследственный рак.
06.05.2011–19.08.2011 — 6 курсов химиотерапии Паклитакселом и Доксорубицином с выраженным положительным эффектом.
Прогрессирование заболевания в сентябре 2011 года: метастатическое поражение костей скелета, головного мозга.
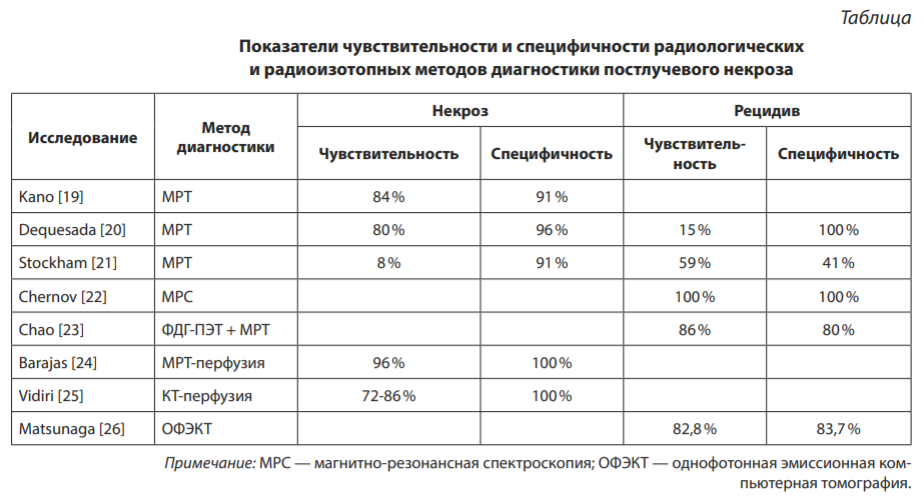
МРТ от 26.09.2011: в правой лобной доле определяется образование до 20 мм с зоной перифокального отёка. Срединные структуры симметричны (рис. 1).
С 17.10.2011 — химиотерапия Капецитабином (завершена в мае 2012 года), таргетная терапия Трастузумабом и введения бисфосфонатов.
17.10.2011–10.11.2011 — паллиативный курс дистанционной лучевой терапии на весь головной мозг, кости свода и основания черепа, РОД 2,5 Гр, СОД 37,5 Гр, затем этап адаптивной стереотаксической радиотерапии на метастаз в правой лобно-теменной области, 5 Гр, ежедневно, СОД 15 Гр (облучение всего головного мозга назначено в соответствии с клиническими рекомендациями — пациентка относилась к благоприятной группе прогноза по системе RPA).
МРТ от 26.12.2011: метастаз в правой лобной доле не определяется (рис. 2).
16.01.2013 — экстирпация матки с придатками (в связи с подозрением на метастатическое поражение яичника).
Гистологическое исследование: зрелая тератома.
Прогрессирование заболевания в апреле — мае 2013 года: метастатическое поражение головного мозга, рецидив опухоли в левой молочной железе.
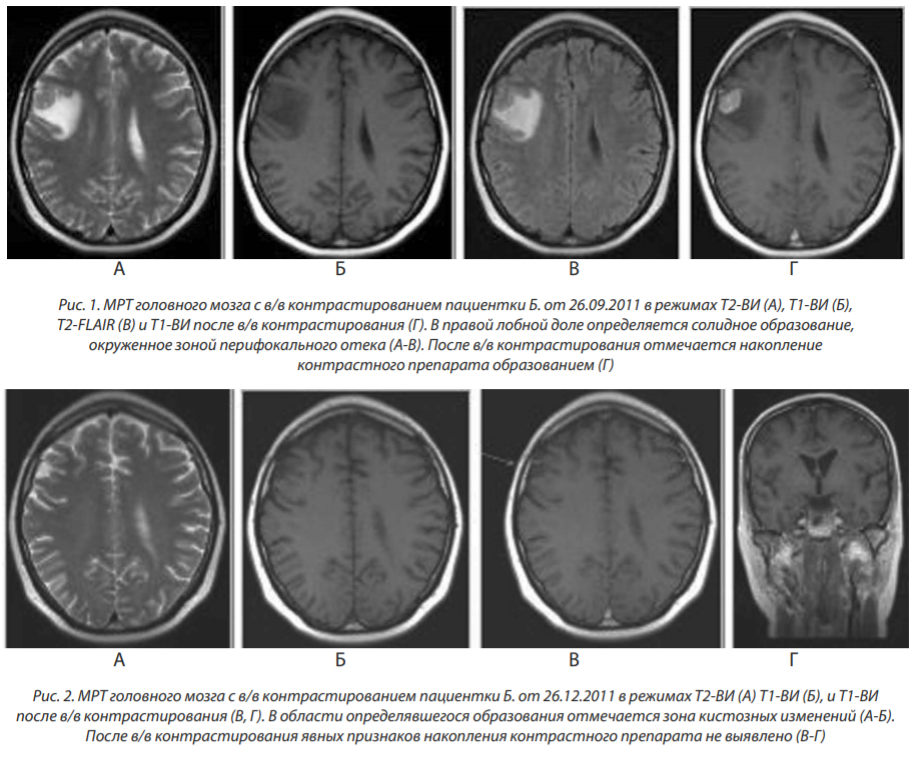
МРТ от 18.04.2013: в правой лобно-теменной области определяется очаговое образование размерами 10×7 мм, накапливающее контрастный препарат по периферии — метастаз (не является рецидивом пролеченного метастаза, располагается в иной области правой лобно-теменной доли) (рис. 3).
Маммография от 06.05.2013: в верхневнутреннем квадранте определяется узловое образование с нечёткими контурами размерами 8×7 мм.
30.05.2013–09.2013 — 4 курса химиотерапии Капецитабином.
06–13.06.2013 — курс стереотаксической радиотерапии на метастаз в правой лобно-теменной области головного мозга, РОД 6 Гр, СОД 30 Гр.
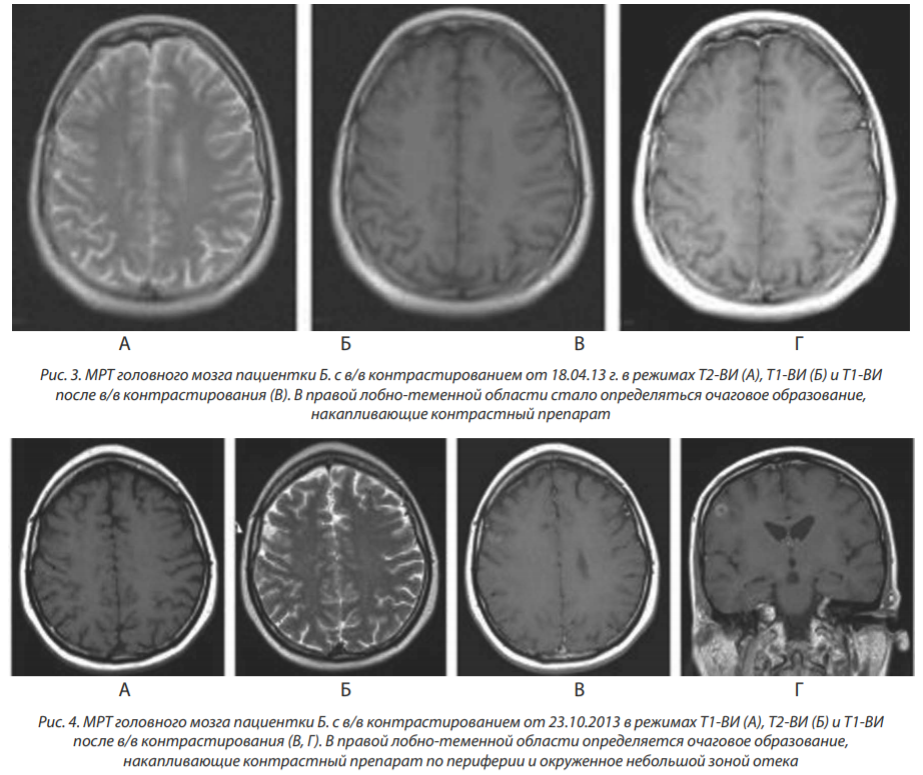
МРТ от 23.10.2013: в правой лобно-теменной области определяется очаговое образование размерами 11×6 мм, накапливающее контрастный препарат (однозначная оценка динамики очага, подвергнутого стереотаксической радиотерапии, не представляется возможной) (рис. 4).
Прогрессирование заболевания в ноябре 2013 года: маммография от 13.11.2013 в сравнении с данными исследования от 06.05.2013: отмечается увеличение размеров и плотности опухолевого узла в верхневнутреннем квадранте левой молочной железы до 17×14 мм. По данным УЗИ в этой зоне — гипоэхогенное образование с кровотоком с нечеткими контурами размерами 14×13 мм. В левой аксиллярной зоне определяется гипоэхогенный лимфатический узел до 5×4 мм (метастаз?)
09.01.2014–07.02.2014 — радикальный курс дистанционной лучевой терапии на левую молочную железу с зонами регионарного лимфооттока, РОД 2,5 Гр, СОД 45 Гр, затем «буст» на опухолевый узел в верхневнутреннем квадранте левой молочной железы, РОД 3 Гр, ежедневно, СОД 12 Гр, в комбинации с химиотерапией Капецитабином (с 09.01.2014 по август 2014 года проведено 10 курсов), таргетной терапией Трастузумабом и лекарственной терапией бисфосфонатами.
УЗИ от 11.04.2014: в тканях молочных желез явные узловые образования не визуализируются, в регионарных зонах — без признаков наличия патологических лимфатических узлов.
Подозрение на прогрессирование заболевания в апреле 2014 года: судорожный приступ с потерей сознания.
МРТ от 10.04.2014: в правой лобно-теменной области определяется очаг размерами 15×9 мм, окруженный зоной перифокального отека (рис. 5).
Проводилась дегидратационная терапия Дексаметазоном с улучшением состояния.
УЗИ от 11.06.2014: в верхневнутреннем квадранте левой молочной железы определяется гипоэхогенная зона размерами до 14×9 мм, в регионарных зонах — без признаков патологических лимфатических узлов.
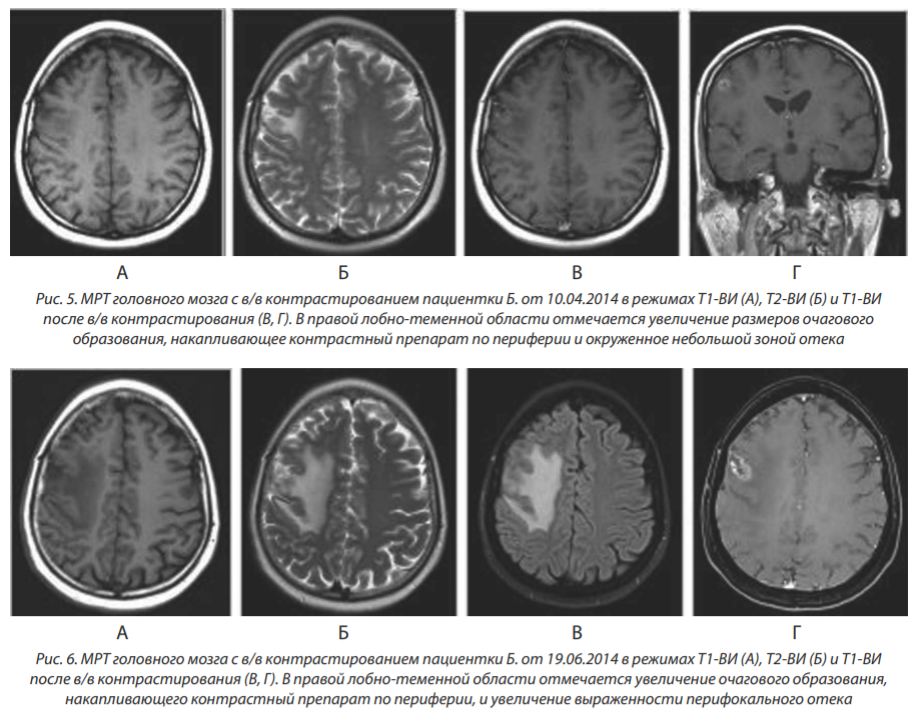
МРТ от 19.06.2014: отмечается увеличение размеров очага в правой лобно-теменной области с 15×9 до 21×10 мм со значительным увеличением зоны перифокального отёка. Также в левой теменной области стали определяться два участка кольцевидного накопления до 2 мм (метастазы?) (рис. 6).
ПЭТ-КТ от 09.07.2014: получены данные о наличии активной опухолевой ткани в правой лобной области, соответствующей участку накопления контрастного препарата по данным МРТ от 19.06.2014 (SUVmax = 1,94, на II этапе до 2,2; наиболее интенсивное накопление в верхнем полюсе образования) — однозначно было расценено диагностом как активная опухолевая ткань (рис. 7).
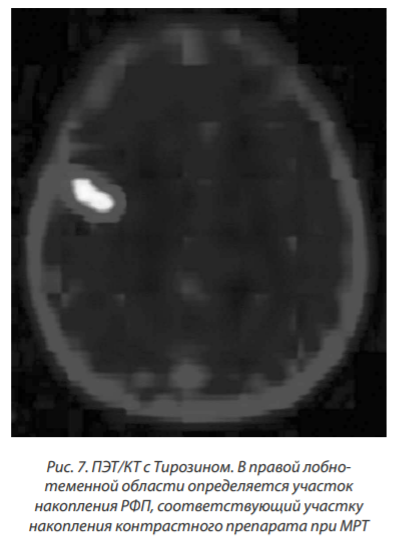
С июля 2014 года частота судорожных приступов увеличилась.
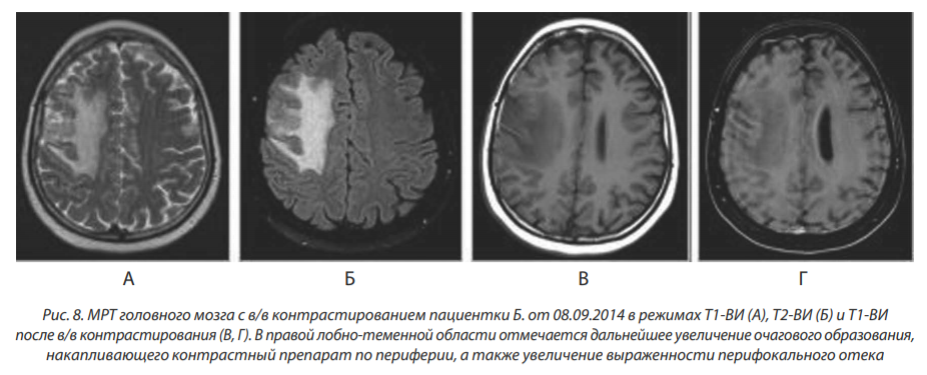
МРТ от 08.09.2014: отмечается дальнейшее увеличение зоны накопления контрастного препарата до 30 мм и зоны перифокального отека (рис. 8).
Маммографии плюс УЗИ от 16.09.2014: в тканях молочных желез явные узловые образования не определяются, в регионарных зонах — без признаков патологических лимфатических узлов.
01.10.2014 — удаление очага в правой лобной области головного мозга (интраоперационно: между двумя корковыми венами определяется изменённый участок коры, подпаянный к твердой мозговой оболочке на участке размерами 15×15 мм).
Гистологическое исследование: Макроскопическое описание удаленного препарата: фрагмент серовато-розовой ткани, размерами 3×3×1,5 см, дряблой консистенции, на разрезе со сливающими желтоватыми очажками в центральных отделах — взят на исследование полностью. Микроскопическое описание: фрагмент полушария головного мозга, частично покрытый мягкой мозговой оболочкой с очагом гипоклеточного фиброза узлового вида с участками вторичной минерализации — ложе организованной гематомы. В субкортикальных отделах удаленного фрагмента полушария отмечаются признаки демиелинизации в виде резкого разрежения белого вещества с формированием микропустот, фокусов коагуляционного некроза, окруженных широким ободком макрофагов с обильной цитоплазмой, с включением астроцитов с реактивной (радиоиндуцированной) атипией; на отдельных участках встречаются сосуды микроциркуляторного русла с субтотальной облитерацией просвета — гистологическая картина отсроченных проявлений постлучевой лейкоэнцефалопатии (рис. 9).
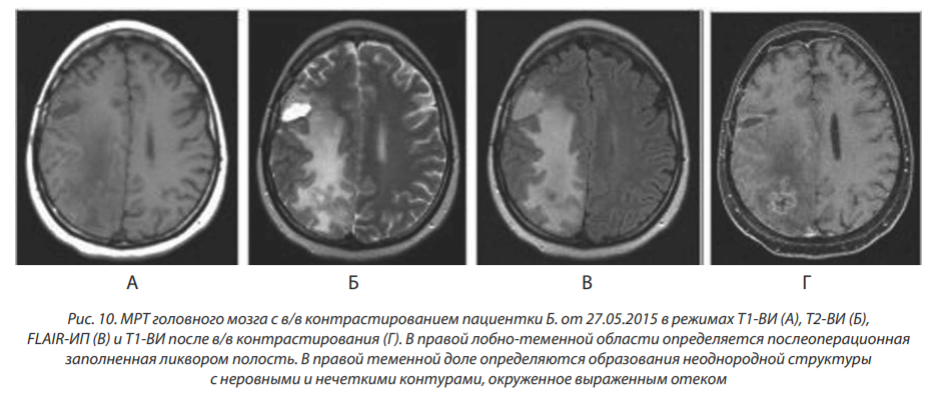
Прогрессирование заболевания в мае 2015 года: МРТ от 27.05.2015 в сравнении с данными исследования от 26.01.2015: отмечается уменьшение размеров послеоперационной полости в правой лобно-теменной области с 33×29 до 25×10 мм. В правой теменной области стало определяться не менее 3 очагов размерами от 6×6×7 до 31×29×36 мм, тесно прилегающих друг к другу, с выраженной зоной перифокального отека (рис. 10).
УЗИ от 01.06.2015: в тканях молочных желез явные узловые образования не определяются, в регионарных зонах — без признаков патологических лимфатических узлов
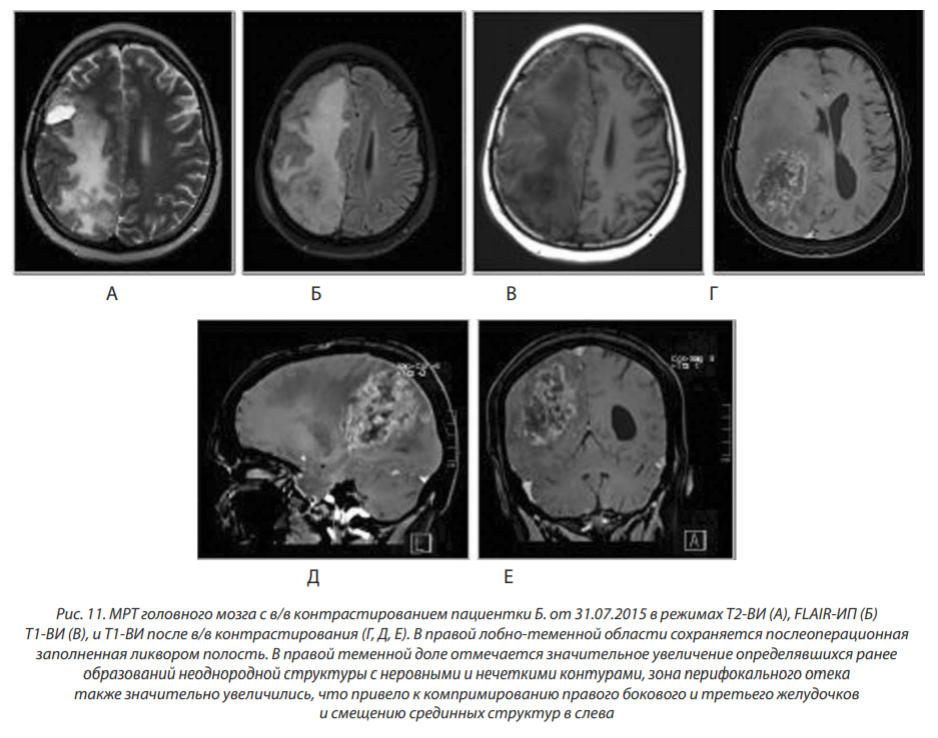
МРТ от 31.07.2015: в правой лобно-теменной области сохраняется послеоперационная полость до 25×10 мм. Отмечается дальнейшее увеличение определявшихся ранее образований в правой теменной области, которые стали сливаться в один массивный конгломерат. Зона перифокального отека в правом полушарии также значительно увеличилась (рис. 11).

С учетом полного использования возможности применения локальных методов лечения было рекомендовано проведение лекарственной терапии Бевацизумабом в монорежиме.
По сообщению родственников, пациентка умерла в июне 2016 года в связи с прогрессированием основного заболевания.
Приведенный клинический случай демонстрирует высокую эффективность комплексного лечения больных раком молочной железы с метастатическим поражением головного мозга (полный эффект комплексного лечения в отношении первого и второго метастазов), что может привести к достижению высоких показателей продолжительности жизни пациенток (в данном случае — 57 месяцев от момента выявления метастатического поражения головного мозга). При этом проведение высокоэффективного комплексного лечения ведет к повышению риска развития постлучевого некроза. Хирургическое удаление растущей зоны постлучевого некроза нивелировало значение неверной интерпретации данных ПЭТ диагностом, в противном случае пациентке могла быть рекомендована химиотерапия Капецитабином и (или) таргетная терапия Трастузумабом (либо некая альтернативная схема, показанная к применению у больных Her2-позитивным раком молочной железы) вместо терапии Бевацизумабом — оптимальной при развитии постлучевого некроза. Указанное является причиной того, что дифференциальная диагностика постлучевого некроза и рецидива или продолженного роста метастаза должна проводиться в рамках мультидисциплинарного консилиума.


