Введение
В России в структуре онкологической заболеваемости женского населения, по данным 2020 г., рак яичников занимает 9‑е место и 8‑е место по смертности, в Приморском крае — 11‑е и 10‑е места, соответственно [1].
Современное лечение рака яичников невозможно без понимания канцерогенеза, структуры злокачественных эпителиальных опухолей яичников и молекулярно-генетического тестирования на дефицит гомологичной рекомбинации [2]. Важным условием для эффективного первичного лечения пациенток с раком яичников является персонализация первой линии терапии, выбор времени начала и режима химиотерапии, поддерживающей терапии. Выбор поддерживающей терапии зависит от наличия мутации в генах BRCA1/2 и HRD-статуса опухоли [3–6].
На сегодняшний день в лечение рака яичников добавилось использование таргетных препаратов, таких как моноклональное антитело против фактора роста эндотелия сосудов — бевацизумаб и ингибитор поли (АДФ-рибоза) полимеразы (ПАРП) — олапариб. ПАРП-ингибитор (олапариб) показан для лечения впервые выявленного серозного или эндометриоидного рака яичников high-grade III–IV стадий у пациенток с дефицитом гомологичной рекомбинации и при лечении рецидивов заболевания [7–9].
Хирургическое лечение первичного распространенного рака яичников имеет важное значение, первичное хирургическое лечение в полном или оптимальном объеме приводит к увеличению выживаемости без прогрессирования и общей выживаемости [10–12].
На основании исследования SOLO-1 предложен новый стандарт лечения пациенток раком яичников III–IV стадий с мутациями в генах BRCA1/2. Добавление олапариба в первой линии позволяет достоверно увеличить время без прогрессирования вне зависимости от исходов и времени операции и ответа опухоли на платиносодержащую терапию [11, 13].
В исследовании PAOLO-1 принимали участие пациентки с серозным или эндометриоидным раком яичников high-grade III–IV стадий, получающие поддерживающую терапию олапарибом в комбинации с бевацизумабом. Пациентки были рандомизированы на две группы: в первой группе получали олапариб в течение двух лет и бевацизумаб в течение 15 мес, во второй группе — бевацизумаб в течение 15 мес и плацебо. Медиана времени до прогрессирования была статистически выше в первой группе и составила 22,1 против 16,6 мес. Риск прогрессирования в первой группе снизился на 60% [14, 15].
Лечение рецидивов рака яичников основано на определении платиночувствительности опухоли и наличия мутации в генах BRCA1/2, что позволяет эффективно планировать терапию рецидива заболевания [16–19]. Поддерживающей терапии олапарибом у пациенток с платиночувствительным рецидивом серозного рака яичников high-grade также посвящено рандомизированное клиническое исследование SOLO-2, где больные были разделены на две группы: первая группа принимала олапариб 600 мг в сутки в поддерживающем режиме, вторая группа — плацебо. Медиана времени до прогрессирования была на 13,6 мес статистически достоверно выше в первой группе, медиана продолжительности жизни — выше на 13 мес [20–23].
Проведенные зарубежные исследования позволили включить таргетную терапию олапарибом в клинические протоколы поддерживающего лечения первичного серозного рака яичников high-grade III–IV стадий с наличием мутации в гене BRCA1/2, дефицита гомологичной рекомбинации и протоколы лечения платиночувствительных рецидивов. В России мало работ, посвященных этой теме, в связи с этим нами выполнен анализ применения олапариба в поддерживающей терапии рака яичников.
Цель − определить эффективность применения олапариба в поддерживающей терапии первой линии в зависимости от мутаций BRCA и вида операции, а также при лечении платиночувствительных рецидивов рака яичников.
Материалы и методы
Анализ генов BRCA1/2 и дефицит гомологичной рекомбинации (HRD) выполнен в рамках программы «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения» (http://www.cancergenome.ru) на базе референтной лаборатории Института химической биологии и фундаментальной медицины СО РАН и в федеральном государственном бюджетном научном учреждении «Медико-генетический научный центр имени академика Н.П. Бочкова».
Проведено ретроспективное исследование 67 пациенток с раком яичников. Критерии включения: серозный рак яичников high-grade I–IV стадии, поддерживающая терапия ПАРП ингибиторами — олапариб в первой линии или в поддерживающем режиме лечения прогрессирования заболевания при условии полного или частичного ответа на платиносодержащую химиотерапию в период с 2016 по 2022 г. Лечение проводилось в ГБУЗ «Приморский краевой онкологический диспансер». Критерии исключения: прогрессирование заболевания на фоне платиносодержащей химиотерапии.
Все пациентки были разделены на две группы:
• 1 группа (27 пациенток) — пациентки с серозным раком яичников high-grade III–IV стадии, получающие олапариб в поддерживающей терапии первой линии в течение двух лет, из них III стадия была у 18 пациенток (66,7%), IV стадия — у 9 пациенток (33,3%);
• 2 группа (39 пациенток) — пациентки с серозным раком яичников high-grade I–IV стадии, получающие олапариб в поддерживающей терапии лечения прогрессирования заболевания и имеющие ответ на платиносодержащую химиотерапию в виде полного или частичного ответа до прогрессирования заболевания или непереносимой токсичности. Из них с I стадией заболевания было 4 пациентки (10,2%), со II стадией — 3 пациентки (7,7%), с III и IV стадиями 27 и 5 (69,2 и 12,9%) соответственно.
Из 39 пациенток второй группы во второй линии поддерживающую терапию олапарибом получали 23 пациентки (59,0%), средняя длительность приема 6,2 мес, в третьей линии — 7 пациенток (17,9%), средняя длительность приема 5 мес, в четвертой линии — 6 пациенток (15,4%), средняя длительность приема 12 мес, в пятой линии и более — 3 пациентки (7,7%), средняя длительность приема 6 мес.
Медиана возраста в первой группе составила 54 года, во второй группе — 60 лет. Различия в возрасте между группами статистически незначимы по критерию Манна — Уитни (р = 0,399). В каждой группе проведен поданализ с учетом наличия мутации в генах BRCA1/2 и сроков выполнения хирургического вмешательства (первичная или интервальная циторедукция). Мутации в генах BRCA1/2 и дефицит гомологичной рекомбинации оценивали в гистологических образцах опухолевой ткани на парафиновых блоках, полученной интраоперационно и в биологическом материале (кровь) методом секвенирования нового поколения (англ. next generation sequencing, NGS).
Полученные данные обрабатывали с помощью стандартных методов статистического анализа выживаемости с использованием программы IBM SPSS Statistics 26. Общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП) рассчитаны по кривым Каплана — Мейера. Рассчитаны медианы выживаемости, представленные в формате M ± SE, где М — медиана выживаемости, SE — стандартная ошибка оценки медианы. Для сравнения медиан выживаемости использован лог-ранговый критерий, значимость различий оценена по критерию χ2, различия принимались статистически значимыми при р < 0,05.
Результаты
За период с 2016 по 2022 г. 67 пациенткам серозным раком яичников high-grade I–IV стадии назначено лечение ПАРП ингибиторами — олапарибом в поддерживающей терапии первой линии или в поддерживающем режиме лечения прогрессирования заболевания при условии полного или частичного ответа на платиносодержащую химиотерапию. Мутация в гене BRCA1 была выявлена у 45 пациенток (83,3%), мутация в гене BRCA2 — у 7 пациенток (13,0%), дефицит гомологичной рекомбинации (HRD) выявлен у двух пациенток (3,7%), у этих двух пациенток имелось сочетание BRCA1/2 и HRD.
В первой группе медиана времени до прогрессирования составила 44,3 ± 1,7 мес, медиана продолжительности жизни совпадает с медианой времени до прогрессирования, одна пациентка погибла вследствие прогрессирования заболевания, остальные живы (рис. 1). Во второй группе медиана времени до прогрессирования составила 23,0 ± 1,5 мес, медиана продолжительности жизни 24,7 ± 2,3 мес (рис. 1, 2).
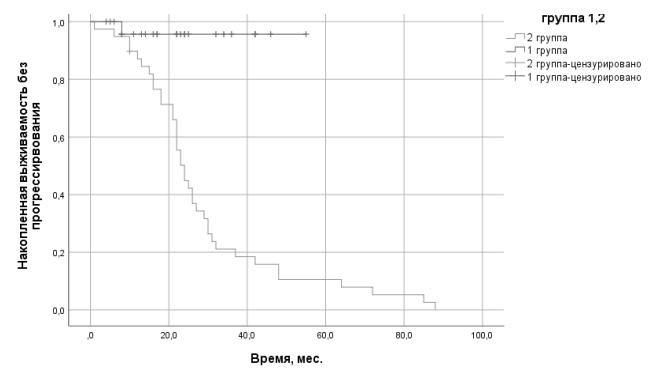
Рис. 1. Общая выживаемость пациенток с серозным раком яичников high-grade 1 и 2 групп*. *Цензурирование означает, что на момент выбытия из-под наблюдения пациент был жив (для общей выживаемости) или не имел прогрессирования (для выживаемости без прогрессирования)
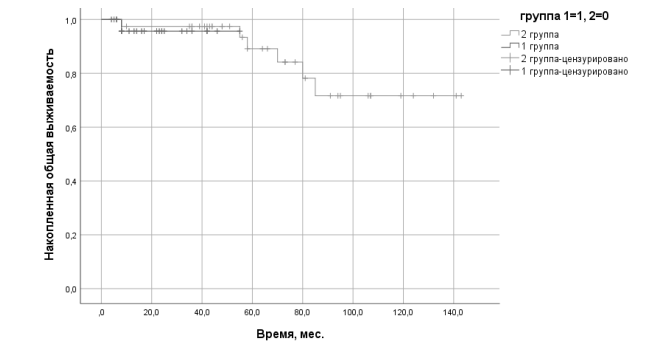
Рис. 2. Выживаемость без прогрессирования пациенток серозным раком яичников high-grade 1 и 2 групп*. *Цензурирование означает, что на момент выбытия из-под наблюдения пациент был жив (для общей выживаемости) или не имел прогрессирования (для выживаемости без прогрессирования)
В первой группе у пациенток с наличием мутации в гене BRCA1 отмечается тенденция улучшения медианы продолжительности жизни и медианы времени до прогрессирования на 21,0 мес, различия статистически не значимы, р = 0,819 (табл. 1).
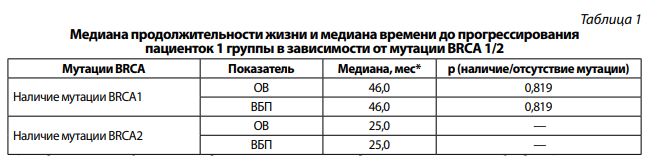
*Стандартные ошибки оценки медианы не вычислены вследствие малого числа наблюдений, в которых произошло событие (смерть или прогрессирование); р невозможно вычислить вследствие отсутствия данных в одной из сравниваемых групп.
При сравнении пациенток первой группы в зависимости от сроков выполненного хирургического лечения медиана продолжительности жизни была статистически выше при первичной циторедукции — 46,0 мес, в группе интервальной циторедукции она составила 25,0 мес (p = 0,018).
При сравнении пациенток второй группы в зависимости от мутации в гене BRCA1 и BRCA2 медиана продолжительности жизни была статистически значимо выше у пациенток с мутацией в гене BRCA2 на 38,6 мес (р = 0,020) (табл. 2).
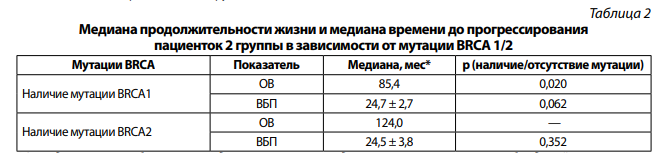
*Стандартные ошибки оценки медианы не вычислены для групп с малым числом наблюдений, в которых произошло событие (смерть или прогрессирование); р невозможно вычислить вследствие отсутствия данных в одной из сравниваемых групп.
Отмечается тенденция улучшения медианы продолжительности жизни и медианы времени до прогрессирования у пациенток второй группы с первичной циторедукцией с мутацией в генах BRCA1/2, различия статистически не значимы (табл. 3).
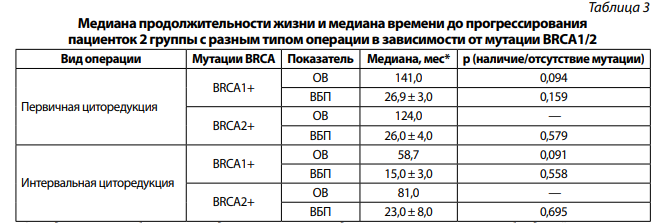
*Стандартные ошибки оценки медианы не вычислены для групп с малым числом наблюдений, в которых произошло событие (смерть или прогрессирование); р невозможно вычислить вследствие отсутствия данных в одной из сравниваемых групп.
Заключение
На сегодняшний день всем пациентам с впервые выявленным серозным или эндометриоидным раком яичников high-grade считается обязательным проведение тестирования на наличие мутации в генах BRCA1/2 и определение дефицита гомологичной рекомбинации [10]. Проведенный нами анализ показал, что у пациенток первичным серозным раком яичников high-grade III–IV стадий с положительным BRCA статусом и/или наличием дефицита гомологичной рекомбинации, получающих лечение в Приморском крае, добавление в поддерживающую схему лечения олапариба позволяет увеличить медиану времени до прогрессирования и медиану продолжительности жизни. Это совпадает с данными других исследований [24]. У 52% пациенток, получавших олапариб в течение 5 лет, не было зафиксировано прогрессирования заболевания [25, 26]. В исследовании SOLO-2 показано, что добавление олапариба в поддерживающем режиме при лечении платиночувствительных рецидивов BRCA-ассоциированного рака яичников позволяет значительно увеличить время до очередного прогрессирования [27–31].
КОНФЛИКТ ИНТЕРЕСОВ
Авторы сообщают об отсутствии конфликта интересов.
ИСТОЧНИК ФИНАНСИРОВАНИЯ
Авторы заявляют о финансировании проведенного исследования из собственных средств.
CONFLICT OF INTEREST
The authors state that there is no conflict of interest.
FUNDING
The authors received no specific funding for this work.


