Артемия — вид, имеющий широкий ареал обитания. Встречается практически по всей планете. Однако основные места обитания — это степи и полупустыни Европы, Азии, Африки и Америки, где она обитает в морских осолоненных лиманах и в соленых континентальных озерах [17]. Наибольшие запасы цист артемии отмечены в Большом Соленом озере (штат Юта, США), где ежегодно заготавливается до 10 тыс. т сырья. Большие запасы этого рачка имеются в водоемах Казахстана, Китая, Туркмении и других стран [12].

На территории Российской Федерации артемиевые озера расположены в основном в южной части Западной Сибири и в Республике Крым [16; 18]. По данным Л. И. Литвиненко [11], в Западной Сибири имеется около 90 артемиевых озер общей площадью порядка 1600 кв. км с запасами цист от 3,0 до 4,0 тыс. т.
В Западной Сибири естественный ареал рачка приурочен к аридной и частично полуаридной зонам равнины и ограничен с севера линией Барабинск — Тюкалинск — Ишим — Шадринск, с юга примыкает к казахскому ареалу рачка в гипергалинных озерах зоны полупустынь. В Алтайском крае его ареал расположен в зоне степи и в меньшей мере — в зоне лесостепи и ограничивается линией Бурла — Хабары — Благовещенка — Завьялово — Родино — Романово — Михайловка [18].
Цисты рачка артемии отличаются высоким и стабильным содержанием белка, незаменимых аминокислот, гормонов, каротиноидов, витаминов и ценных жирных кислот. В виде живого корма используют на разных этапах жизненного цикла, чаще всего это науплии, реже используются взрослые особи. Цисты этого гидробионта тоже используются для кормления после предварительной декапсуляции. Наиболее часто в рыбоводстве используют науплии, полученные путем инкубации цист [13; 14]. В настоящее время науплиусы артемии являются важным источником живого корма для ранних стадий большинства культивируемых видов рыб и ракообразных [5; 7; 22]. Все это позволило цистам артемии стать ценным биоресурсом, представляющим коммерческий интерес.
Для единовременного получения максимального количества науплий применяют физические или химические способы активации. В. П. Соловов [17] показал, что большинство заготавливаемых цист требуют предварительной активации, которая может проводиться двумя способами:
— имитацией естественного режима активации цист, при котором создаются необходимые температурные и другие условия для завершения диапаузы;
— с использованием различных химических реагентов, ускоряющих биохимические процессы в диапаузирующем яйце.
Наиболее значимыми параметрами инкубации являются: концентрация цист в инкубационном растворе; качество воды, используемой для инкубации; температура; минерализация; освещенность; рН раствора; содержание кислорода; постоянная аэрация, обеспечивающая нахождение цист во взвешенном состоянии; экспозиция.
В настоящее время существует ряд способов и методов активации цист с использованием различных веществ. Наиболее часто используемым веществом для активации является перекись водорода [4; 8; 11].
Одним из первых методов инкубации цист артемии был предложенный в 1973 году В. А. Копец и др. [9]. Для подготовки цист артемии к массовому культивированию авторы рекомендовали провести предварительную сушку. Затем в течение 1–3 месяцев промораживание в растворе поваренной соли (60,0–130,0 г/л) в холодильнике при температуре от –3 до –15 °C с периодическим, каждые 5–7 дней, размораживанием в течение 3–10 часов до температуры +5–8 °C.
Впервые использование перекиси водорода в качестве активатора инкубации цист артемии было описано в работе И. Б. Богатовой и З. И. Шмаковой [2]. По их методу для обеспечения полного выклева науплиусов из диапаузирующих яиц жаброногих ракообразных следует выдерживать цисты в 3–10-процентном растворе перекиси водорода в течение 5–20 минут при –18–22 °C из расчета 200–400 см 3 цист на 1 л раствора. Ими была установлена прямая зависимость между концентрацией активатора и процентом выклева, но при этом выявлен порог, когда высокая концентрация перекиси водорода негативно сказывается на выклеве артемии, что приводит к снижению числа инкубируемых науплий [2].
И. Б. Богатова и Ж. И. Ерофеева [1] предлагают проводить активацию цист в процессе инкубации, внося 33-процентную перекись водорода непосредственно в солевой раствор из расчета 0,1–0,3 мл на 1 л инкубационного раствора.
А. Г. Селюков и др. [15] предложили способ активации с использованием генераторов сверхслабого объемно-модулируемого магнитного поля. Установлено, что обработка с использованием парафизических технологий диапаузирующих яиц артемии в осенний период приводит к высокому, до 72–88% (контроль — от 12 до 22%), выклеву при инкубации в стандартном растворе соли в осенний и зимний периоды. Обработка в осенний и летний периоды повышает интенсивность выхода до 70–97% (контроль — от 8 до 20%) с одновременным сокращением сроков вылупления при инкубации.
Способ увеличения выхода науплиусов, предложенный Е. Е. Гусевым [6], заключается в том, что при активации цист артемии в заданной среде в цисты вводят ионы Н+, а среду обогащают ионами ОН– . Введение ионов Н+ осуществляют путем активации цист в среде, содержащей уксусную кислоту, с рН, равным 3, или н-масляную кислоту с рН, равным 3,5, выдерживая их соответственно 2–10 или 2–5 минут. Обогащение среды ионами ОН– осуществляют за счет использования подщелоченного гиперосмотического раствора, в котором цисты выдерживают 40–60 минут. В качестве подщелоченного гиперосмотического раствора используют раствор поваренной соли, подщелоченной гидроксидом натрия. Это позволяет повысить всхожесть цист без истощения их энергетических и пластических ресурсов, а также возможность хранения их с повышенной всхожестью после обработки.
Nieuwenhove Luk Van и др. [21] предлагают вносить в инкубационную среду не перекись водорода, а имеющие пероксидные связи, такие как пероксиды, пербораты, персульфаты и перацетаты. Наиболее предпочтительными производящими перекись водорода соединениями являются перекись магния и кальция. Эти соединения имеются в виде твердых веществ, которые содержат обычно от 50 до 70% активного вещества. Преимущество использования этих веществ состоит в том, что они могут быть перемешаны с сухими цистами перед упаковкой.
Существует способ повышения выклева науплиусов при применении следующей технологии инкубации: в инкубационный раствор соленостью 30,0–35,0 г/л при температуре +25–30 °C добавляют цисты и 33-процентную перекись водорода из расчета 10 г Н2 О2 на 1 кг внесенных диапаузирующих яиц. Воду активно в течение 60 минут аэрируют сжатым воздухом. После чего в инкубационный раствор добавляют трийодтиронин и тетрайодтиранин в равных весовых соотношениях в общем количестве от 0,5 до 5,0 мкг на 1 л инкубационного раствора [8].
Однако существуют методики с применением и других химических веществ. Так, Yuqing Chen и Bo Zhang [23] в своей статье описали влияние нестандартных химических активаторов на инкубацию цист, в частности применялась аскорбиновая кислота (витамин С). В результате был установлен оптимальный диапазон концентрации вещества, способствующий наиболее высокому проценту выклева цист.
По мнению Р. А. Клепикова [8], хорошо зарекомендовали себя в качестве активатора аскорбат и изоаскорбат (эриторбат) натрия, применение которых позволяет получить стабильно высокий выклев. Аскорбат натрия представляет собой белый кристаллический порошок. Преимуществами его являются безопасность для потребляющих активированные им цисты (аскорбат натрия — это пищевая Е-301, эриторбат натрия — Е-316) и возможность длительное время сохранять свою активность. Кроме того, чрезмерное, сверх необходимого для повышения выклева количества активатора не снижает выклев, что делает его более удобным в применении промышленного производства стартовых кормов.
Ввиду того, что экологические условия каждого гипергалинного водоема индивидуальны, не существует общепринятых стандартных условий для проведения инкубации цист. Для цист из каждого водоема имеются свои параметры, характерные именно для этой популяции: концентрация цист в инкубационном растворе; качество воды, используемой для инкубации; температура; минерализация; освещенность; рН раствора; содержание кислорода; постоянная аэрация, обеспечивающая нахождение цист во взвешенном состоянии; экспозиция [3; 8]. Исходя из этого приходится подбирать методику инкубации опытным путем.
Целью нашей работы стало определение влияния различных концентраций аскорбиновой кислоты на выклев цист артемии из озер Купинского района Новосибирской области.
Нами был проделан ряд экспериментов с применением аскорбиновой кислоты в качестве активатора цист. Для получения данных для сравнения использовался активатор — перекись водорода.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЙ
Материалом для исследования послужили цисты Artemia sp. из гипергалинных озер Барбаши, Сахалин, Владимировка Купинского района Новосибирской области, заготовленные в 2017 году.
Процесс инкубации проводился по стандартной методике: соленость воды — 3%, температура воды — 28 °C, при постоянной аэрации и освещении 2000 лк. На 1 л инкубационного раствора закладывался 1 г сырых цист [11].
В каждой серии опытов контролем служила партия, инкубируемая в стандартном растворе соли (3%), во все остальные варианты добавлялся активатор при различной концентрации: 0,5; 1,0; 1,5; 2,0; 2,5 г/л для аскорбиновой кислоты, 0,5; 1,0; 1,5; 2,0; 2,5 мл/л для перекиси водорода.
Для оценки качества выклева использовали показатель Н%, который рассчитывается по формулам (1, 2):
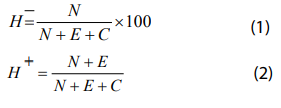
где: N — число науплий, Е — число эмбрионов, С — число цист.
Полученные результаты были обработаны статистически.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В результате исследований максимальный Н% был получен с применением аскорбиновой кислоты при инкубации цист артемии из озера Барбаши — 67,2%, при этом использование Н2 О2 позволило получить выклев 67%, но при концентрации вещества 0,5 мл/л. При этом при концентрации витамина С 1,5 г/л выклев составил 48,8%, а при этой же концентрации Н2 О2 выклева не было. При использовании обоих веществ в концентрации выше 1,5 в качестве активатора для цист озера Барбаши получено большое число эмбрионов (табл. 1).
Таблица 1
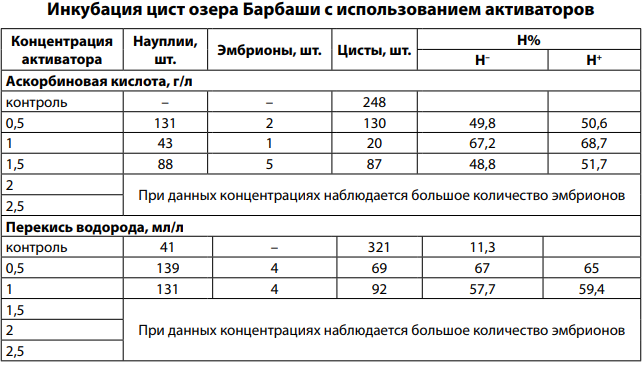
Для цист из озера Сахалин характерен максимальный выклев науплиев при концентрации аскорбиновой кислоты 0,5 г/л, при этом при концентрациях от 2 г/л наблюдается большое количество эмбрионов при стандартных условиях инкубации. Активация перекисью водорода способствовала выклеву цист из озера Сахалин только при концентрации 0,5 мл/л (табл. 2).

Максимальный выклев (Н%) цист озера Владимировка при активации аскорбиновой кислотой получен при концентрации вещества 0,5 г/л (табл. 3). Активация перекисью водорода не привела к выклеву выше 70% при выбранных концентрациях. Максимум 22,2% получили при достаточно высокой концентрации перекиси водорода — 2,5 мл/л (табл. 3).
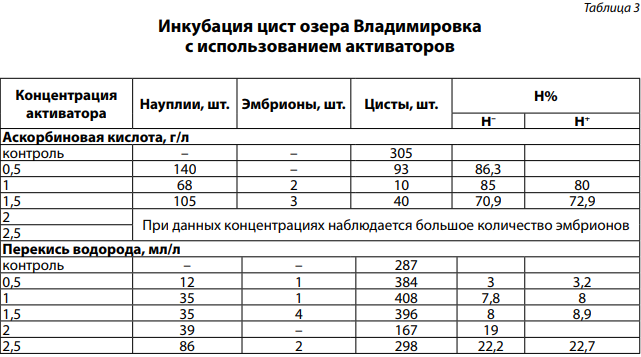
Практическое применение активатора цист заключается в получении большего числа науплий (рис. 1). По этой причине необходимо подобрать «рабочую» концентрацию вещества, при которой Н%, а значит, большое количество науплий будет иметь максимальное значение. На всех исследуемых водоемах при концентрации 0,5 г/л было получено максимальное число науплий (140, 131 шт.). Минимальное значение при 1,0 г/л — 43, 51, 68 шт. Такие образом, «рабочая» концентрация для всех исследуемых нами озер находилась в диапазоне 0,5–0,9 г/л и, возможно, является индивидуальной для каждого озера.
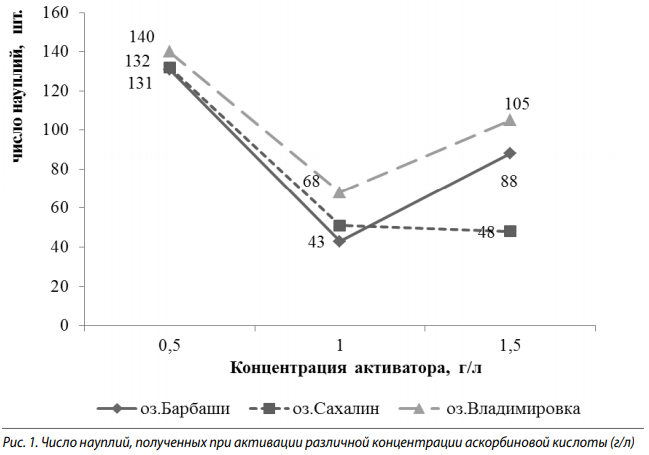
При использовании в качестве активатора перекиси водорода максимальное количество науплий для озер Барбаши и Сахалин было получено при 1,0 мл/л — 139 и 116 шт., при повышении концентрации рабочего раствора выклева не происходило. На озера Владимировка при 2,5 мл/л — 86 шт. (рис. 2). Таким образом, «рабочая» концентрация перекиси водорода для озер Барбаши и Сахалин находится в диапазоне 1,0–1,4 мл/л, а для озера Владимировка — выше 2,5 мл/л.
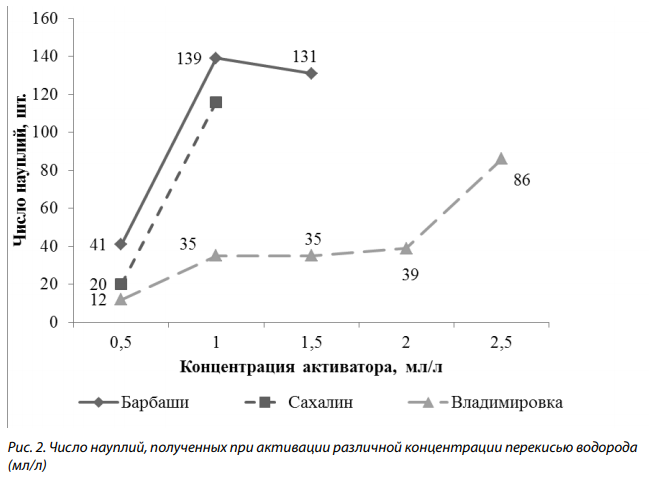
Таким образом, применение активаторов Н2 О2 и витамина С способствует получению максимального процента выклева, но при одинаковых инкубационных условиях невозможно получить высокое число науплий из цист с разных озер. Инкубационные условия могут быть стандартными, но концентрацию активатора необходимо подобрать индивидуально для каждого озера.


