Введение
Рак прямой кишки (РПК) представляет собой одну из актуальных и сложных проблем современной онкоколопроктологии. Распространенность заболевания и смертность населения от этой патологии по-прежнему остаются высокими. Так, только в России в 2014 году зарегистрировано 26785 новых случаев рака прямой кишки, а смертность составила 9,2 %. В структуре онкологической заболеваемости рак прямой кишки занимает 6-е место (5,2 %) среди мужчин и 7-е место (4,7 %) среди женщин [1]. В ряду колоректальных раков особое место занимают раки прямой кишки низких локализаций (ниже 6 см), при лечении которых применяются комбинированные методы, а частота местных рецидивов, несмотря на выполнение зачастую инвалидизирующих операций, значительно выше.
Магнитно-резонансная томография является диагностическим методом, сочетающим в себе преимущества пространственного и контрастного разрешения в сочетании с отсутствием лучевой нагрузки. Для низких локализаций рака прямой кишки неоспорима диагностическая роль МРТ в прогнозировании вовлечения латерального края резекции, так как на уровне мышц, поднимающих задний проход, толщина мезоректума значительно тоньше, чем в верхне- и среднеампулярных отделах прямой кишки [2, 3]. Высокое пространственное разрешение МР-изображений в коронарных плоскостях позволяет четко визуализировать леваторы ануса, комплекс внутренних и наружных сфинктеров и межсфинктерное пространство, что используется для стадирования низких колоректальных опухолей и планирования объема хирургического вмешательства (стандартная операция, сфинктеросохраняющая резекция, экстралеваторная брюшно-промежностная экстирпация прямой кишки) [4–8].
С помощью магнитно-резонансной томографии возможно визуализировать как нормальные вены мезоректальной клетчатки в виде серпигиозных структур с низким МР-сигналом, так и венозные сосуды патологической структуры при опухолевой инвазии. Это позволяет включить МРТ-исследование в стандартный протокол определения распространенности нижнеампулярного рака прямой кишки в предоперационном стадировании низких раков, непосредственно влияющем на дальнейшую тактику их лечения [10–14].
Глубина инвазии опухоли может указывать на наличие эктрамуральной сосудистой инвазии, так как гистологически определяемая сосудистая инвазия обычно связана с опухолями, которые относятся хотя бы к Т3 стадии. Поэтому небольшие опухоли, по данным МРТ, явно ограниченные мышечным слоем стенки кишки, не имеют потенциала для возникновения сосудистой инвазии [15, 16]. Группой ученых была доказана более высокая чувствительность МРТ в сравнении с гистопатологическими данными в определении эктрамуральной сосудистой инвазии [17].
Таким образом, оценка МР-изображений при эктрамуральной сосудистой инвазии должна включать в себя анализ краев опухоли, расположения опухоли относительно крупных сосудов, калибр и границы сосудов.
В соответствии с вышеуказанными четырьмя критериями оценки была предложена пятибалльная система оценки экстрамуральной сосудистой инвазии для предоперационной МРТ [18]. Самый низкий балл — 0, соответствует отсутствию каких-либо признаков сосудистой инвазии. Максимальный балл — 4, соответствует случаям, когда видны явные особенности измененного сосуда (расширенная и неровная граница сосуда). Более высокие баллы связаны с худшей выживаемостью пациентов. Низкие баллы не связаны с наличием сосудистой инвазии или неблагоприятным исходом заболевания. Стратификация пациентов по показателю МРТ экстрамуральной сосудистой инвазии клинически актуальна как для предоперационного лечения пациентов, так и для послеоперационного наблюдения.
Одним из немногих минусов МРТ в определении сосудистой инвазии является тот факт, что не всегда с абсолютной уверенностью можно утверждать, что структура является сосудистой, и это обстоятельство является важным ограничением в рентгенологической оценке эктрамуральной сосудистой инвазии.
Из-за ограничений разрешения микроскопические примеры эктрамуральной сосудистой инвазии не выявляются при МРТ. Пациенты с опухолевой инвазией крупных сосудов имеют худший прогноз, в то время как сосудистая инвазия, негативная на МР-изображениях, может иметь минимальное клиническое значение [18]. В научных работах не освещена проблема взаимосвязи морфологического типа опухоли и наличия эктрамуральной сосудистой инвазии.
Целями нашего исследования были определение взаимосвязи между наличием экстрамуральной сосудистой инвазии и морфологическим типом опухоли, а также наличием метастазов рака нижнеампулярного отдела прямой кишки и последующая оценка прогностического значения выявления сосудистой инвазии при первичном предоперационном МРТ-исследовании, влияние его на дальнейшую тактику лечения пациента.
Материалы и методы
В исследуемую группу вошел 81 пациент с раком нижнеампулярного отдела прямой кишки на различных стадиях, из них 49 (60,5 %) составляли мужчины и 32 (39,5 %) женщины, средний возраст пациентов в группе составил 62,2 ± 9,3 лет. По результатам первичных биопсий опухолей, выполненных при колоноскопии и ректосигмоскопии, у 59 человек была выявлена умеренно дифференцированная аденокарцинома, у 14 — низко дифференцированная аденокарцинома, у 8 человек — высоко дифференцированная аденокарцинома.
Всем пациентам проводилась комплексная лучевая диагностика, включавшая компьютерную томографию органов брюшной полости с болюсным контрастным усилением, компьютерную томографию органов грудной клетки и магнитно-резонансную томографию малого таза. МРТ малого таза выполнялась на магнитно-резонансном томографе GEOptimaMR450wGEM с использованием поверхностной и встроенной в стол катушек по стандартизированному протоколу, включавшему три серии Т2-ВИ (в аксиальной, сагиттальной и коронарной плоскостях) толщиной 3 мм, одну серию аксиальных Т1-ВИ и серию аксиальных диффузно-взвешенных изображений (ДВИ) с диффузионными факторами b = 500 и b = 1000 c/мм2 . Компьютерная томография органов брюшной полости и органов грудной клетки проводилась с целью выявления отдаленных метастазов. Исследование выполнялось на компьютерном томографе SIEMENS SOMATOM Emotion 6 (Siemens Medical Systems, Германия), с применением неионных йодсодержащих контрастных веществ «Сканлюкс 300» и «Омнипак 300» в виде болюсного контрастирования.
Комплексная лучевая диагностика проводилась с целью стадирования опухоли по системе TNM для определения последующей тактики лечения. Из 81 пациента исследуемой группы 37 человек было прооперировано в течение года после комплексного обследования. Наличие экстрамуральной сосудистой инвазии, выявленной до операции при выполнении МРТ, во всех случаях подтверждалось результатами патоморфологического исследования интраоперационного материала. Морфологический тип опухоли определялся путем гистологического исследования биопсийного материала.
У 10 из 37 пациентов (27 %) имелась экстрамуральная инвазия сосудов различного калибра, при этом в 6 случаях выявлено метастатическое поражение регионарных лимфоузлов, в двух случаях — метастазы периферической зоны предстательной железы в сочетании с поражением регионарных лимфоузлов, в остальных двух случаях (20 %) выявленной сосудистой инвазии метастазов не обнаружено. В группе больных, у которых сосудистой инвазии не было, в одном случае встретился метастаз в регионарный лимфоузел, в одном случае диагностирован метастаз в подвздошную кость, в остальных 25 случаях (93 %) метастазов не было.
При анализе материала использовались стандартные методы математической статистики. Вычисляли достоверность различий с помощью критерия χ2 Пирсона с поправкой Йейтса и z-критерия и коэффициенты корреляции признаков.
Результаты
Распределение оперированных пациентов по морфологии и стадии опухоли представлено в таблицах 1 и 2.
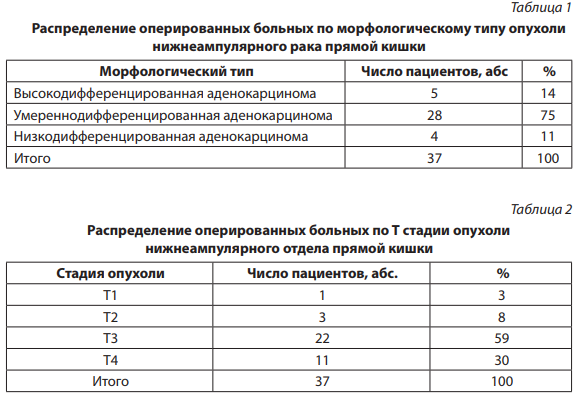
Из 37 оперированных пациентов у 28 была выявлена умеренно дифференцированная, у 4 — низко дифференцированная, у 5 — высокодифференцированная аденокарцинома. Наличие сосудистой инвазии было диагностировано в двух случаях при низко дифференцированной аденокарциноме и в восьми случаях умеренно дифференцированной аденокарциномы; в случаях высоко дифференцированных аденокарцином нижеампулярного рака прямой кишки сосудистой инвазии не было.
На рисунке 1 видно, что имелась линейная зависимость частоты выявления сосудистой инвазии в зависимости от степени дифференцированности опухоли. Для расчета коэффициента корреляции качественному признаку — морфологическому типу опухоли было присвоено определенное количество баллов: 1 балл — высокодифференцированная, 2 — умеренно-, 3 — низкодифференцированная опухоль. Коэффициент корреляции частоты выявления сосудистой инвазии и степени дифференцированности опухоли составил 0,997 ± 0,007, то есть был очень высоким (Р = 0,05). Таким образом, вероятность развития сосудистой инвазии напрямую зависит от степени дифференцированности аденокарциномы нижеампулярного рака прямой кишки.
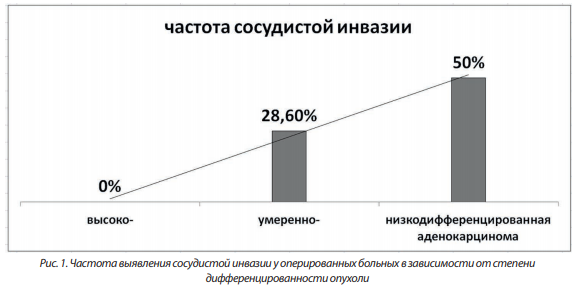
Однозначного соответствия частоты выявления сосудистой инвазии и Т-стадии рака нижнеампулярного отдела прямой кишки у оперированных пациентов выявлено не было (табл. 3). Вероятнее всего, это обусловлено малой выборкой пациентов со стадиями Т1, Т2 и Т4 (60 % больных имели стадию Т3). Частота сосудистой инвазии составила 0 % у пациентов с Т1 стадией рака, 33,3 % — у пациентов с Т2, 22,7 % — у пациентов с Т3 и 36,4 % у пациентов с Т4. Тем не менее, тенденция к росту частоты выявления сосудистой инвазии при более продвинутых стадиях рака налицо (рис. 2).
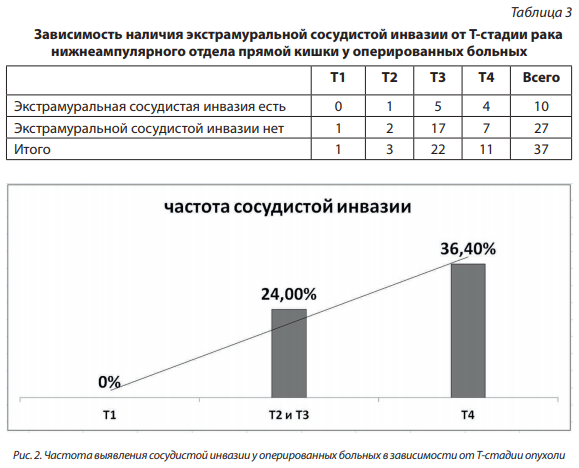
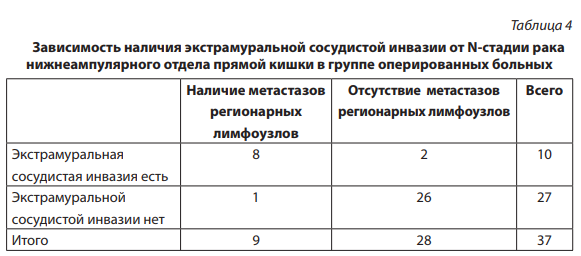
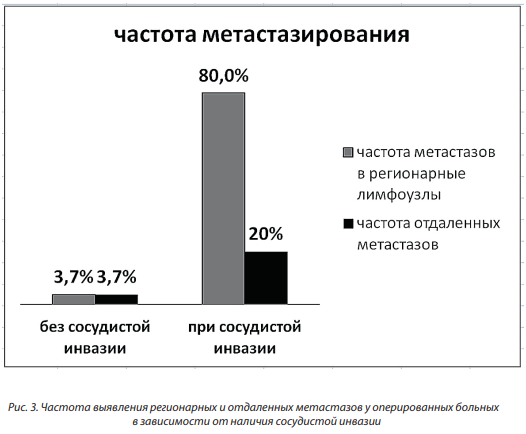
Частота выявления метастатического поражения локорегионарных лимфатических узлов у пациентов с раком нижнеапмулярного отдела прямой кишки представлена в таблице 4. При наличии экстрамуральной сосудистой инвазии метастазы в лимфоузлы выявлялись в 20 раз чаще, чем в ее отсутствие (рис. 3). Разница частоты регионарного метастазирования при сосудистой инвазии и в ее отсутствие составила 76 ± 16 % (Р < 0,001). Отдаленные метастазы выявлялись при наличии сосудистой инвазии в 5 раз чаще, чем при ее отсутствии, однако последние различия недостоверны из-за малого объема выборки (Р = 0,1).
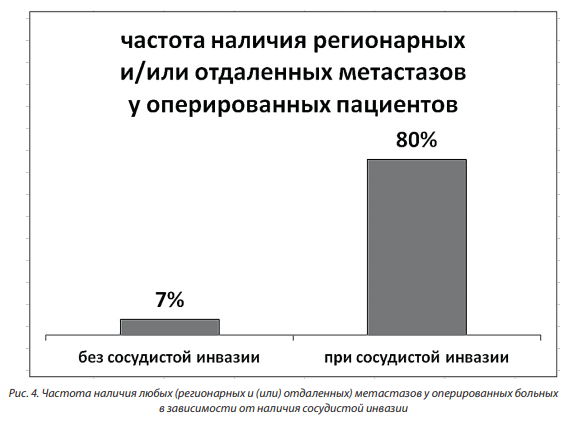
На рисунке 4 представлена частота наличия любых метастазов (регионарных и/или отдаленных) у оперированных пациентов. Разница частоты наличия любых метастазов при сосудистой инвазии и в ее отсутствие составила 73 ± 13 % (Р < 0,001, 95 %-ный доверительный интервал разницы 41–100 %).
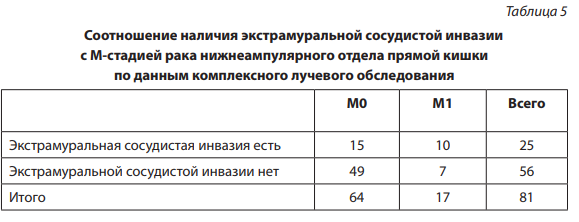
Анализ зависимости между наличием экстрамуральной сосудистой инвазии и наличием отдаленных метастазов был выполнен также по данным комплексного лучевого обследования 81 пациента с раком нижнеампулярного отдела прямой кишки. Данные представлены в таблице 5.
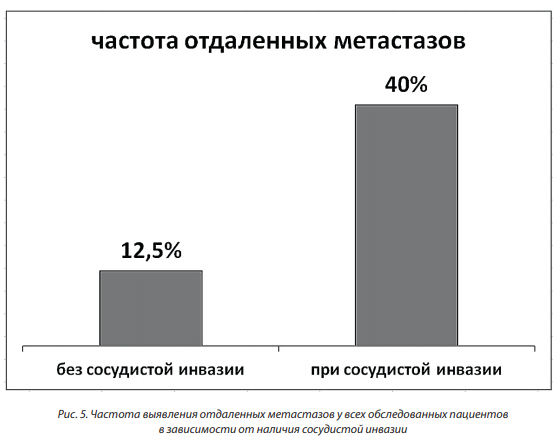
Частота развития отдаленных метастазов была в 3 раза или на 27,5±9,8 % выше при наличии у больных сосудистой инвазии (рис. 5), различия достоверны (Р < 0,02, 95 %-ной ДИ разницы 8,3–46,7 %). При наличии экстрамуральной сосудистой инвазии метастатическое поражение печени встречалось в полтора раза чаще, чем поражение легких, что может быть связано с типом метастазирования рака прямой кишки.
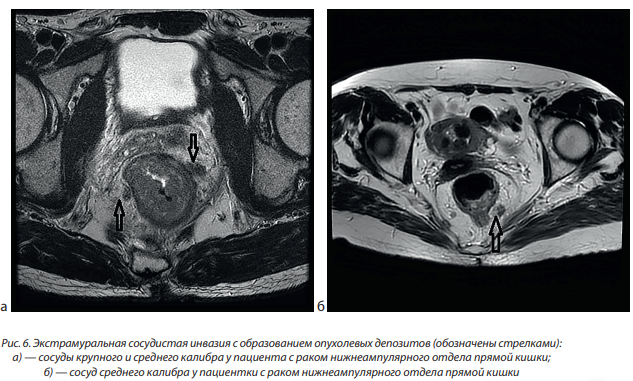
На рисунке 6 представлены примеры МРТ-изображений гистологически подтвержденной экстрамуральной сосудистой инвазии сосудов различного калибра у прооперированных пациентов с раком нижнеампулярного отдела прямой кишки.
Заключение
У больных с раком нижнеампулярного отдела прямой кишки частота выявления сосудистой инвазии коррелирует с морфологическим типом опухоли, и имеется статистически значимая взаимосвязь между экстамуральной сосудистой инвазией и наличием как регионарных, так и отдаленных метастазов. Таким образом, выявляемая методом МРТ сосудистая инвазия при нижнеампулярном раке прямой кишки может служить индикатором высокого риска наличия регионарных и отдаленных метастазов. Это особенно важно при невозможности проведения полного комплексного лучевого обследования пациента.


