ВВЕДЕНИЕ
Когнитивный дефицит и снижение когнитивных функций с течением времени ассоциируются с сердечно-сосудистыми заболеваниями, такими как артериальная гипертензия, сахарный диабет, фибрилляция предсердий и с развитием цереброваскулярных изменений. В ряде исследований было высказано предположение, что распространенность когнитивных нарушений связана с количеством и выраженностью сосудистых факторов риска, одним из которых является дислипидемия [3, 16–19]. Дилипидемия — повышенное содержание в крови концентрации холестерина (ХС) в составе липопротеинов низкой (ХС ЛПНП) или очень низкой плотности (ХС ЛПОНП), снижение концентрации холестерина в липопротеинах высокой плотности (ХС ЛПВП) — является основным патогенетическим компонентом атеросклеротического процесса.
Согласно современным представлениям, атеросклероз как причина серьёзных васкулярных событий рассматривается в качестве прогрессирующего полифакторного воспалительного заболевания, развивающегося вследствие взаимодействия модифицируемых и немодифицируемых факторов риска в комплексе с молекулярными, генетическими и наследственными [2].
Риск смерти вследствие осложнений распространенного атеросклероза повышен у больных как с симптомным, так и асимптомным течением, но у пациентов с клиническими проявлениями этот риск в 2–3 раза выше, чем без них [1, 3].
В настоящее время антиатеросклеротическая терапия статинами рассматривается как долговременная стратегия первичной и вторичной профилактики сердечно-сосудистых заболеваний и тяжелых ишемических исходов (смерть, инсульт, инфаркт) [10, 12]. Данный класс препаратов подтвердил эффективное влияние на снижение смертности от опасных сердечно-сосудистых осложнений при их отличной переносимости и высокой безопасности [5–7, 9, 11].
Уникальность данного класса препаратов заключается не только в способности значительно снижать синтез ХС, но и останавливать прогрессирование атеросклероза. Позитивное действие статинов обусловлено целым рядом и других свойств под названием «плейотропные эффекты». Поэтому главным заданием лечения статинами является не только стабилизация атеросклеротического процесса, но и его обратное развитие [9, 15]. Единственным универсальным классом лекарственных средств, которые не только блокируют синтез атерогенного ХС, но и влияют на апоптоз и стабилизируют состояние атеросклеротической бляшки (АБ), являются именно статины [2, 9].
В современной литературе обговаривается нейропротективный потенциал ингибиторов ГМГ-КоА-редуктазы. В экспериментальном исследовании была выявлена меньшая степень выраженности неврологических симптомов, если церебральный инсульт возникал на фоне лечения статинами [5].
Большой интерес вызывает перспектива использования статинов для профилактики когнитивных нарушений. Было показано, что статины снижают риск развития деменции. При анализе данных, полученных в Cardiovascular Health Study (2005), была установлена легкая связь между приемом статинов и уменьшением риска возникновения когнитивных нарушений у лиц пожилого возраста [16]. В другом исследовании также продемонстрировано позитивное влияние аторвастатина (по данным нейропсихологического тестирования) на когнитивные функции в дозе 10 мг/сут в течение 6 мес [13]. Другие авторы не отметили, что длительное использование правастатина и симвастатина способствует снижению заболеваемости деменцией или темпа прогрессирования когнитивных нарушений (исследования PROSPER и Heart Protection Study) [14]. Таким образом, этот вопрос остается дискуссионным.
Способность статинов замедлять атеросклеротическое поражение брахиоцефальных сосудов дает основание для углубленного изучения возможности использования данной группы препаратов в рамках профилактики развития инфаркта мозга. Кроме того, учитывая нейропротективное действие статинов, представляется актуальным изучение влияния препаратов данной группы на когнитивные функции у пациентов с фибрилляцией предсердий.
Цель исследования — оценить клиническую эффективность розувастатина у пациентов с фибрилляцией предсердий по его влиянию на когнитивные функции, церебральную гемодинамику и состояние сосудистой стенки.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Обследовано 112 пациентов (85 мужчин, 27 женщин) с дисциркуляторной энцефалопатией (ДЭ) на фоне персистирующей или пароксизмальной форм фибрилляции предсердий (ФП) в возрасте от 40 до 70 лет. Средний возраст пациентов составил 58,7 ± 6,3 года. В клинической картине заболевания присутствовали легкие и умеренные когнитивные нарушения. Клиническая характеристика пациентов представлена в табл. 1. У обследованных пациентов средняя концентрация общего ХС крови составила 6,74 ± 1,26 ммоль/л, ХС ЛПНП — 4,10 ± 1,10 ммоль/л.
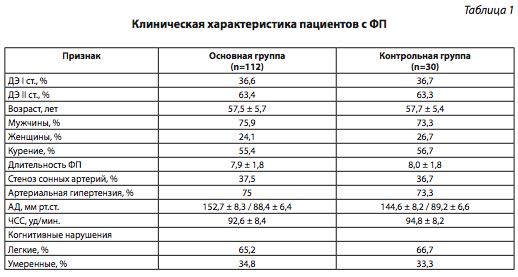
Все участники исследования путем простой рандомизации были разделены на две группы: больные основной группы (n = 112), которые помимо базовой медикаментозной терапии и коррекции факторов риска (рекомендаций по изменению образа жизни, гиполипидемической диеты) получали розувастатин в начальной дозе 20 мг/сут вечером независимо от приема пищи, и пациенты контрольной группы (n = 30), которым проводили только базовую медикаментозную терапию и были даны рекомендации по изменению образа жизни, гиполипидемической диете с целью коррекции предикторов развития и прогрессирования атеросклероза. Пациенты во время исследования получали базовую терапию антиагрегантами (100%), антиаритмическими (100%), антигипертензивными средствами (84,5%) и курсовую (в течение первых 2 мес) терапию вазоактивными препаратами. Все антиаритмические и антигипертензивные средства, которые были назначены, сохраняли нейтральное действие на липидный обмен.
Первоначально больные обследовались в течение первых 3 дней с момента поступления в стационар, затем через 1, 3 и 6 мес. Лабораторный мониторинг проходил в указанные выше периоды, исследование когнитивных функций и проведение дуплексного сканирования брахицефальных артерий (ДС БЦА) в начале и в конце периода наблюдения (через 6 мес). Средний уровень ЧСС при включении в исследование составлял 92,6 ± 8,4 и 94,8 ± 8,2 уд/мин в группах розувастатина и плацебо соответственно; АД — 152,7 ± 8,3 / 88,4 ± 6,4 и 154,6 ± 8,2/89,2 ± 6,6 мм рт. ст. в соответственно.
В план обследования входил комплекс стандартных лабораторных и инструментальных процедур, включавший: клинические анализы крови и мочи, биохимический анализ крови с оценкой уровней общего ХС и липидных фракций (ХС ЛПНП, ХС ЛПВП), ТГ, определялся индекс атерогенности, уровень АСТ, АЛТ, щелочной фосфатазы, билирубина прямого, билирубина непрямого (для оценки безопасности лечения статинами) исходно, через 1 и 6 мес. Биохимическое исследование проводили на автоматическом биохимическом анализаторе HUMASTAR-300 (Германия).
Регистрацию ЭКГ проводили на аппарате Heart Screen 60G (Венгрия) в 12 стандартных отведениях с анализом ритма сердца. Всем пациентам проводили постоянный ЭКГ-мониторинг системой «INNO-CARE-5» (Венгрия).
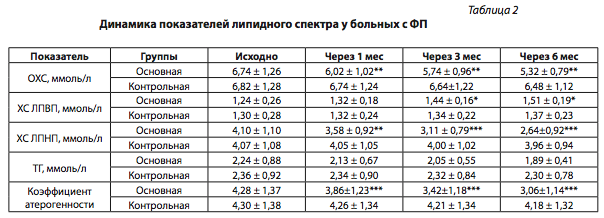
Примечание: * – достоверность между показателями до и после лечения р < 0,05 (М ± m); ** – р < 0,01; *** – р < 0,001.
Выполнено нейропсихологическое тестирование пациентов с помощью краткой шкалы оценки высших психических функций (MMSE), батареи тестов на лобную дисфункцию (FAB), Монреальской шкалы когнитивной оценки (МОСА), теста рисования часов, таблиц Шульте, а также исследование зрительной памяти по Рыбакову.
ДС БЦА в экстракраниальном отделе проводили на аппарате Mylab-25, Esaote S.p.a (Италия) по стандартной методике при помощи линейного мультичастотного датчика с частотой 6,0–11,0 кГц. Оценивали состояние сосудистой стенки: подвижность (ригидность или гиперпульсацию), толщину комплекса интима-медиа (КИМ), эхогенность. Измерение толщины КИМ в общей сонной артерии (ОСА) проводили по задней стенке ОСА, на расстоянии 1–1,5 см проксимальнее самого дистального ее участка. За нормальные значения толщины принимали величину до 1,0 мм. Кроме того, оценивали состояние просвета сосуда (бляшки, тромбы, локальные утолщения и др.) и характеристику АБ [8].
В период включения в исследование две группы пациентов не отличались между собой по полу, возрасту, ЧСС, уровню офисного АД, данным лабораторных обследований (параметры клинического и биохимического анализов крови, клинического анализа мочи), уровню образования и данным дуплексного сканирования, что свидетельствует об их репрезентативности.
Клиническая эффективность препарата розувастатина оценивалась на основании динамики показателей: липидного спектра (ХС, ХС ЛПВП, ХС ЛПНП, ТГ и индекса атерогенности); нейропсихологических тестов (шкалы MMSE, БТЛД, шкалы МОСА, теста рисования часов, таблиц Шульте, исследования зрительной памяти по Рыбакову); ДС БЦА.
Переносимость препарата определялась на основании динамики нижеуказанных параметров: субъективных жалоб пациента; объективных данных, полученных исследователем в ходе наблюдения; лабораторных показателей.
Статистическую обработку данных проводили с помощью пакета программ Statistiсa 6.0. Вероятность разницы между группами пациентов и в динамике по ряду показателей определяли на основании tкритерия Стьюдента. Результаты анализа считались статистически значимыми при значении р < 0,05 и высокодостоверными при р < 0,001.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
После 1-го мес приема розувастатина липидный спектр крови нормализовался в большинстве случаев и не достиг целевого уровня у 44 (39,3%) больных основной группы, в связи с чем этим пациентам доза препарата была увеличена до 40 мг/сут. Через последующие 2 мес лечения розувастатином целевые уровни ХС ЛПНП были достигнуты еще у 12 пациентов, у которых предыдущая доза препарата была неэффективной. К концу периода наблюдения целевых значений ОХС и ХС ЛПНП достигли 80 (71,4%) больных, принимавших розувастатин. Наиболее выраженный эффект розувастатин продемонстрировал в отношении атерогенной фракции ХС ЛПНП, снизив ее на 35,6%, а уровень ОХС — на 21,1%. Таким образом, розувастатин продемонстрировал выраженный гиполипидемический эффект (табл. 2).
После курсового лечения розувастатином 84,8% больных отметили улучшение общего самочувствия, памяти и внимания, в то время как только 46,7% пациентов контрольной группы субъективно отметили улучшение когнитивных функций. В динамике (через 6 мес) проведена объективная оценка когнитивных функций у обследуемых больных по нейропсихологическим тестам (табл. 3).
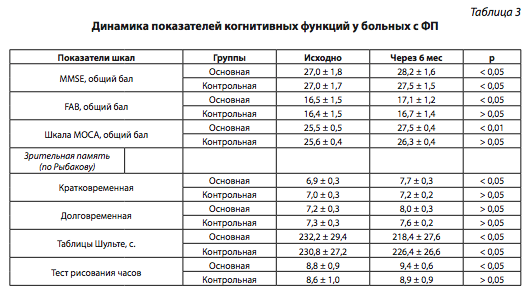
Анализ результатов по шкале MMSE показал, что статистически достоверное улучшение когнитивных функций по сравнению с их исходным состоянием отмечалось у больных обеих групп, но различия между группами были недостоверными. Однако достоверная позитивная динамика по FAB, шкале МОСА, показателям зрительной памяти и активного внимания наблюдалась только у пациентов, принимавших розувастатин.
В результате ДС БЦА у обследованных больных выявлено умеренное атеросклеротическое поражение брахиоцефальных сосудов. Толщина КИМ ОСА в традиционном месте в начале лечения составила 0,88 ± 0,08 мм у пациентов основной группы и 0,87 ± 0,06 мм — контрольной. Исследование толщины КИМ через 6 мес показало отсутствие статистически значимых изменений в обеих группах (0,86 ± 0,04 и 0,89 ± 0,04 мм соответственно, р > 0,05). Одностороннее поражение сонных артерий выявлено у 60 (53,6%) пациентов, двустороннее поражение — у 12 (10,7%), сочетанное поражение ОСА и внутренней сонной артерии (ВСА) — у 29 (25,9%). Всего обнаружено 95 АБ. При этом по протяженности выявлено 72 (64,3%) локальных (менее 15 мм вдоль продольного сечения) АБ, 33 (29,5%) пролонгированных (более 15 мм относительно поперечного сечения сосуда), 22 (19,6%) концентрических, 28 (25,0%) полуконцентрических, 63 (56,2%) локальных. Сонные артерии справа и слева поражались с одинаковой частотой.
Стойкая положительная динамика через 6 мес приема розувастатина при анализе данных ДС БЦА заключалась в стабилизации АБ у 77 (68,8%) пациентов: стали преобладать АБ 3-го типа (гетерогенные с преобладанием «плотного» компонента) у 52 (46,4%) пациентов и 4-го типа (гомогенные «плотные» АБ) — у 25 (22,3%); уменьшении количества нестабильных, склонных к эмболизации, АБ (гомогенных «мягких» и гетерогенных гипоэхогенных) на 8,42 и 22,1% соответственно; регистрировалась ровная поверхность АБ у 87 (77,7%) пациентов против 52,7% наблюдений исходно.
В основном преобладала малая (30– 49%) степень стеноза в 83,0% случаев. Умеренные стенозы (50–69%) были выявлены у 15,2% пациентов, гемодинамически значимый стеноз (70–99%) — у 3 (2,7%) пациентов. В среднем степень стенозирования просвета сосуда составила 42,6 ± 12,4%.
В результате лечения у пациентов основной группы на фоне приема розувастатина достоверно увеличилась ЛССК по БЦА (табл. 4).
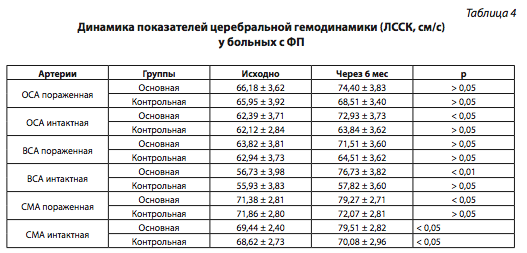
Примечание: ВСА — внутренняя сонная артерия.
Значимая положительная динамика наблюдалась в ОСА и ВСА по показателю ЛССК на условно интактной стороне. В контрольной группе в конце наблюдения достоверного увеличения ЛССК по магистральным экстракраниальным сосудам головного мозга выявлено не было. Исследование кровотока по интракраниальным артериям показало статистически значимое увеличение ЛССК в сонной мозговой артерии (СМА) с двух сторон. В результате лечения произошло статистически значимое снижение периферического сопротивления кровотоку в измененных магистральных сосудах головного мозга — ОСА и ВСА.
В период лечения и наблюдения розувастатин хорошо переносился всеми пациентами, уровень трансаминаз крови в ходе терапии у 9 пациентов не достигал даже двукратного увеличения. У 11 пациентов в течение первой недели приема препарата наблюдались умеренно выраженные диспепсические явления (тошнота), которые прошли самостоятельно.
ВЫВОДЫ
1. В ходе исследования при приеме розувастатина выявлен выраженный гиполипидемический эффект, который приводил к достоверному снижению уровня ОХС, ХС ЛПНП, ТГ, увеличению ЛПВП.
2. На фоне терапии розувастатином отмечалось улучшение когнитивных функций по результатам нейропсихологического тестирования, что оправдывает его применение у пациентов с персистирующей и пароксизмальной формами фибрилляции предсердий, сопровождающейся когнитивной дисфункцией.
3. Стойкая положительная динамика через 6 мес приема розувастатина при анализе данных ДС БЦА заключалась в замедлении прогрессирования атеросклеротического процесса в сонных артериях; уменьшении толщины КИМ; стабилизации АБ; уменьшении количества нестабильных, склонных к эмболизации, АБ; увеличении ЛССК по БЦА.
4. Полученные в исследовании данные об эффективности и безопасности ранней терапии статинами (розувастатином) позволяют рекомендовать терапию статинами с первых суток госпитального этапа лечения всем больным с когнитивной дисфункцией на фоне фибрилляции предсердий, не имеющих противопоказаний к данному классу препаратов, что достоверно снижает уровень когнитивного дефицита и улучшает прогноз заболевания.


