Профилактика инфекционных болезней является одной из главных задач в обеспечении эпизоотического благополучия птицеводческих хозяйств [1, 2]. Особого внимания заслуживают болезни, связанные с патологией респираторного тракта, при которых посредством воздушно-капельной передачи происходит быстрое распространение возбудителей.
На долю респираторных инфекций приходится не менее 40 % от общего числа инфекционных болезней птицы. В большинстве случаев респираторные инфекции протекают в ассоциациях, что затрудняет их диагностику, снижает эффективность противоэпизоотических мероприятий и наносит существенный экономический ущерб предприятиям [3, 4].
С целью профилактики респираторных инфекций вирусной этиологии используют живые и инактивированные вакцины. Для профилактики бактериальных респираторных болезней применяют антибиотики широкого спектра действия. Однако их регулярное применение приводит к возникновению антибиотикорезистентности у возбудителей болезней, развитию у птицы дисбактериозов, снижению естественной резистентности и поствакцинального иммунитета, ухудшению качества продукции птицеводства [5–8].
В связи с этим на данном этапе развития птицеводства актуальным остается вопрос о разработке эффективных схем профилактики бактериально-ассоциативных респираторных болезней птиц с использованием экологически безопасных средств. Примерами таких средств являются прополис и препараты на его основе. Известны антимикробное, анестезирующее, антиоксидантное, иммуномодулирующее, дерматопластическое, противотоксическое, противовоспалительное свойства прополиса. Установлена высокая эффективность настойки прополиса для лечения телят и поросят при бронхопневмонии и болезнях желудочно-кишечного тракта. В птицеводстве настойку прополиса применяли для повышения сохранности и продуктивности.
Установлена бактерицидная активность настойки прополиса на возбудителей респираторных инфекций птиц в опытах in vitro [9].
Разработана и испытана в производственных условиях схема профилактики респираторных инфекций в инкубаторе с использованием настойки прополиса [10, 11].
Цель исследований – разработать и изучить различные схемы применения настойки прополиса для профилактики респираторной инфекций птиц бактериальной этиологии.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Исследования проведены в фермерском птицеводческом хозяйстве Омской области, где при эпизоотологическом обследовании была выявлена ассоциативная бактериальная респираторная инфекция, и в отделе ветеринарии сельскохозяйственной птицы СибНИИП – филиала ФГБНУ «Омский АНЦ».
Объектом исследования была настойка прополиса (100 г прополиса, 80 %-ный спирт до получения 1 л настойки) производства ООО «Гипократ» (Россия, г. Самара).
Для реализации поставленной цели из суточных цыплят-бройлеров кросса Росс-308 по принципу аналогов скомплектованы контрольная и две опытные группы по 100 голов в каждой, размещенные в отдельных изолированных помещениях. Для профилактики респираторной инфекции применяли препараты в соответствии со схемой опыта (табл. 1).
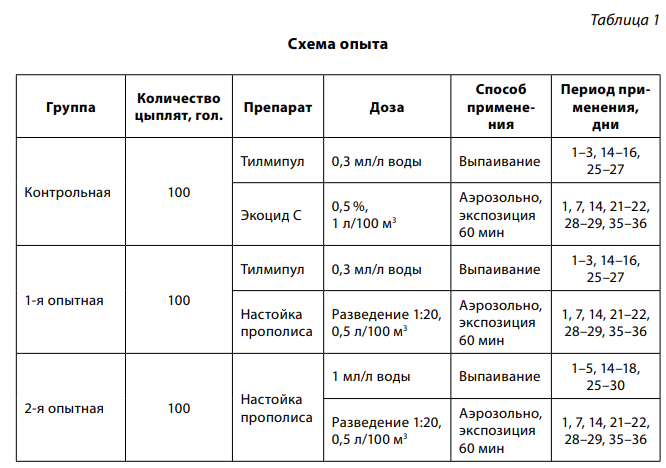
Для получения мелкодисперсного аэрозоля использовали аэрозольный распылитель HURRICANE (модель 2792).
Профилактическую эффективность различных схем оценивали по наличию клинических признаков у цыплят, их сохранности и живой массе. Учитывали результаты бактериологических, гематологических, биохимических, иммунологических исследований.
Материалом для прижизненных лабораторных исследований служили соскобы со слизистой оболочки гортани, пробы крови и ее сыворотки, для посмертных – стенки воздухоносных мешков, кусочки легких, соскобы с трахеи, головной и костный мозг, кровь из сердца, печень, селезенка. Отбор проб, выделение культур микроорганизмов и их идентификацию проводили в соответствии с существующими методиками с использованием простых и дифференциально-диагностических питательных сред.
Морфологию изучали в мазках из суточных агаровых культур, окрашенных по Граму и Романовскому-Гимзе, биохимические свойства – посевом на среды Гисса с сахарами.
Патогенность культур стафилококков устанавливали реакцией плазмокоагуляции с применением кроличьей цитратной плазмы, остальных выделенных культур – постановкой биопробы на лабораторных мышах.
Микробиологическое исследование воздуха проводили седиментационным методом по Коху, расчет – по формуле Омелянского [12].
Количество форменных элементов крови подсчитывали в счетной камере Горяева под микроскопом после предварительного разведения крови в меланжерах красителем Болотникова. Общий белок в сыворотке крови определяли биуретовым, альбумин бромкрезоловым методами наборами Hospitex diagnostics (Италия), содержание гемоглобина в крови – гемихромным методом набором «Гемосо-Ново» (Россия).
Бактерицидную активность сыворотки крови (БАСК) определяли по методу Мишеля Теффера в модификации О. В. Смирновой и Т. А. Кузьминой [13].
Учет результатов осуществляли с помощью спектрофотометра Elх800. Результаты исследований обрабатывали методом статистики с использованием критерия Стьюдента [14].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Сохранность цыплят за период опыта во 2-й группе на 3 % превышала показатели контрольной и 1-й групп и составила 98 %.
Причиной гибели цыплят во 2-й группе на 2-й и 3-й неделе выращивания были травма и мочекислый диатез, возбудителей инфекционных болезней бактериальной этиологии не выявлено. Клинических признаков респираторной болезни у цыплят 2-й группы не наблюдалось на протяжении всего опыта.
Основной отход птиц в контрольной и 1-й группах был на 4-й и 5-й неделе выращивания, что совпало с проявлением клинических признаков у цыплят данных групп. Так, на 4-й неделе выращивания в контрольной и 1-й группах выделились цыплята со значительным отставанием в росте, у которых наблюдалось снижение аппетита, вялость, напряженное дыхание, трахеальные хрипы, истечения из носа, чихание, опухание тканей в области подглазничных синусов. При патолого-анатомическом вскрытии погибшей птицы из контрольной и 1-й групп наблюдали отечность и множественные точечные кровоизлияния на слизистых оболочках гортани и трахеи, синусит, отек легких, двустороннюю серозную и серозно-фибринозную пневмонию, фибринозный аэросаккулит, в единичных случаях – серозно-фибринозный перигепатит, гиперплазию и анемию селезенки, дистрофию печени и почек. Бактериологическим исследованием биоматериала от погибшей птицы выделены Ornitobacteria rhinotracheale, Staphylococcus aureus, Enterococcus faecalis, Escherichia coli, Citrobacter diversus, Providencia stuartii, Enterobacter agglomerans, Proteus mirabilis. Возбудители в 100 % случаев выделялись в ассоциациях, основными представителями в которых были Staphylococcus aureus, Escherichia coli, Enterococcus faecalis. Монокультуры изолированы не были.
Таким образом, результаты клинических, патолого-анатомических и бактериологических исследований подтвердили наличие у цыплят контрольной и 1-й групп ассоциативной респираторной инфекции бактериальной этиологии на фоне проведенных профилактических мероприятий с применением антибиотика.
Наименьший спектр микроорганизмов выделен в соскобах со слизистой оболочки гортани цыплят-бройлеров опытных групп, где проводили аэрозольные обработки воздуха птичников настойкой прополиса. В 1-й группе были выделены Enterococcus faecium и Enterobacter agglomerans, во 2-й группе – Enterococcus faecium и Citrobacter freundii.
У цыплят контрольной группы изолировали Escherichia coli, Staphylococcus aureus, Proteus mirabilis, Enterococcus faecalis, Enterococcus faecium.
Аналогичные данные получены и при бактериологическом исследовании воздуха (табл. 2).
В первый день опыта общее микробное число (ОМЧ) между всеми группами отличалось незначительно.
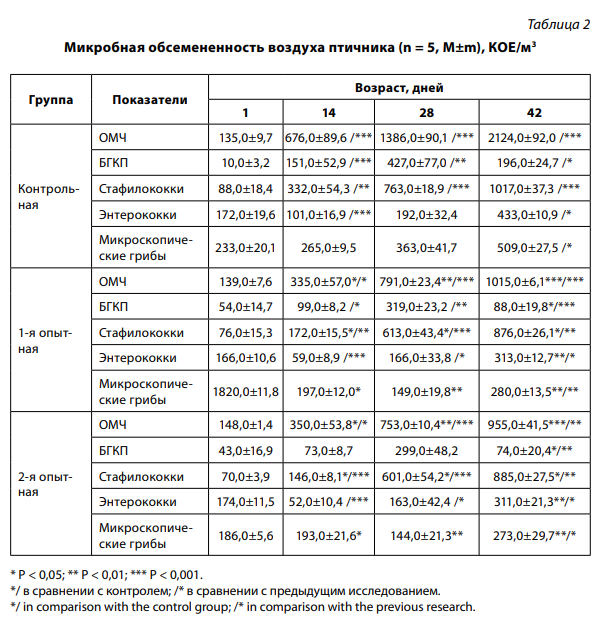
На 14-й день опыта наименьшее ОМЧ отмечено в 1-й и 2-й группах, где проводили аэрозольные обработки прополисом, при этом разница с контрольной составила 341 и 326 КОЕ/м3 соответственно.
После аэрозольных обработок прополисом на 28-й день опыта в 1-й группе показатель ниже на 595, во 2-й – на 633 КОЕ/м3 по сравнению с контрольной группой, где аэрозольная обработка проводилась Экоцидом С.
На 42-й день опыта прослеживалась та же тенденция, при этом ОМЧ в 1-й группе ниже на 1109, во 2-й – на 1169 КОЕ/м3 по сравнению с контролем в этот же период.
Количество БГКП до 28-дневного возраста в воздухе залов всех групп увеличилось при наименьших показателях в опытных группах. На 42-й день данный показатель снизился во всех группах, чему способствовало увеличение количества обработок, но в зале с контрольной группой он оставался самым высоким: разница с 1-й составила 108, со 2-й – 122 КОЕ/м3 . С увеличением возраста птицы количество стафилококков в воздухе всех залов повысилось. В 1-е сутки опыта отмечалось незначительное отличие между группами. На 14-й день опыта количество стафилококков в воздухе зала с контрольной группой увеличилось на 244, в 1-й – на 96, во 2-й – на 76 КОЕ/м3 по сравнению с первым днем. На 28-й и 42-й дни опыта показатель микробной обсемененности воздуха в опытных группах был самым низким, разница достоверна. На 42-й день разница сконтролем в 1-й группе составила 141, во 2-й – 132 КОЕ/м3. .
Количество энтерококков на 14-й день опыта в воздухе зала контрольной группы по сравнению с первым днем снизилось на 71, 1-й – на 107, 2-й – на 122 КОЕ/м3 . На 28-й день опыта количество энтерококков в воздухе всех залов увеличилось, при этом лучшие результаты оставались в опытных группах. В контрольном зале этот показатель повысился на 140, в зале 1-й группы – на 107, 2-й – на 111 КОЕ/м3 по сравнению с предыдущим исследованием. Аналогичная тенденция прослеживалась и на 42-й день опыта, разница с контролем в 1-й группе составила 120, во 2-й – 122 КОЕ/м3 .
Обработка воздуха опытных залов настойкой прополиса способствовала снижению количества микроскопических грибов. На 14-й день количество микроскопических грибов по сравнению с первым днем возросло во всех группах: в 1-й – на 15, во 2-й – на 7, в контрольной – на 32 КОЕ/м3 . На 28-й день в опытных группах количество микроскопических грибов в воздухе снизилось: в 1-й – на 48, во 2-й – на 49, в контрольной – на 98 КОЕ/м3 по сравнению с предыдущим исследованием.
На 42-й день опыта количество микроскопических грибов в воздухе залов всех групп увеличилось при наименьших показателях в опытных группах. Разница с контролем в 28 и 42 дня в 1-й группе составила 214 и 229, во 2-й – 219 и 236 КОЕ/м3 . Аэрозольная обработка воздуха настойкой прополиса в залах с 1-й и 2-й группами позволила снизить количество патогенных и услов но-патогенных микроорганизмов по сравнению с контрольной группой, где применяли Экоцид С. Наличие у цыплят-бойлеров контрольной и 1-й групп респираторной инфекции на фоне применения антибиотика для профилактики отрицательно отразилось на росте птицы и ее физиологическом состоянии.
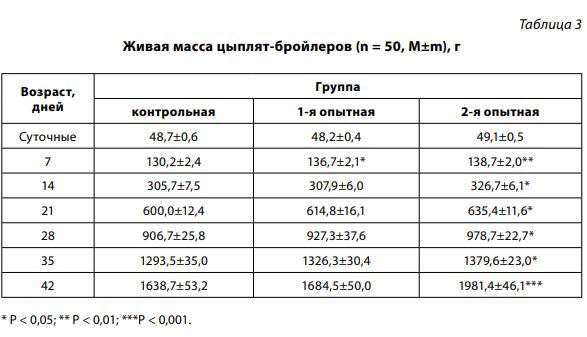
Наибольшая живая масса цыплятбройлеров на протяжении всего опыта с достоверной разницей отмечалась во 2-й группе, где с профилактической целью использовали только настойку прополиса (выпаивание и аэрозольно), без применения антибиотиков и дезинфектантов (табл. 3).
Так, в 42-дневном возрасте живая масса цыплят 2-й группы превысила контрольную и 1-ю на 342,7 и 296,9 г соответственно.
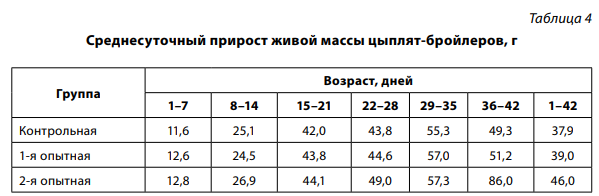
В 1-й группе живая масса цыплят на 45,8 г превысила контрольную, разница недостоверна. Наибольшее снижение скорости роста цыплят контрольной и 1-й групп регистрировали в возрасте 22–28 дней (табл. 4), что совпало с проявлением клинических признаков респираторных инфекций и гибелью птицы в данный период.
Снижение среднесуточного прироста живой массы цыплят 1-й и контрольной групп в возрасте 36–42 дня также являлось следствием болезни птиц на фоне профилактического применения антибиотика.
Стабильный рост цыплят 2-й группы на протяжении всего опыта при применении настойки прополиса свидетельствовал об интенсификации обменных процессов, естественного иммунитета в организме молодняка и отсутствии негативного влияния антибиотика, что подтверждалось результатами исследований крови.
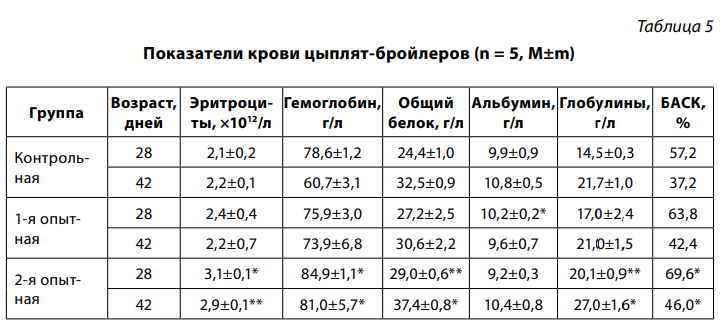
Количество эритроцитов в крови цыплят 2-й группы в возрасте 42 дня превысило контрольную и первую группы на 0,7х1012/л, содержание гемоглобина – на 20,3 г/л по сравнению с контрольной и на 7,1 г/л – с 1-й (табл. 5).
Содержание общего белка в крови цыплят 2-й группы в 28 и 42 дня было на 4,6 и 4,9 г/л больше по сравнению с контрольной и на 1,8 и 6,8 г/л – по сравнению с 1-й соответственно. Та же тенденция прослеживалась и в отношении содержания глобулинов в сыворотке крови.
Бактерицидная активность сыворотки крови (БАСК) цыплят-бройлеров 2-й группы в период выпаивания настойки прополиса (28 дней) была выше контрольной на 12,4, 1-й – на 5,8 %. В 42 дня показатель БАСК снизился у всех цыплят при наибольших показателях во 2-й группе. Низкие показатели в крови цыплят-бойлеров контрольной и 1-й групп можно связать как с заболеванием, так и с отрицательным влиянием антибиотика на организм птиц.
Наличие в контрольной и 1-й группах респираторной инфекции на фоне трехкратного применения антибиотика (в возрасте 1–3; 14–16; 25–27 дней) свидетельствовало об отсутствии профилактической эффективности последних и целесообразности их применения для профилактики. Кроме того, антибиотики оказывали угнетающее действие на иммунную и кроветворные системы молодняка, обмен веществ, естественную резистентность организма, что способствовало возникновению инфекционных заболеваний и снижению экономических показателей выращивания бройлеров.
Наиболее эффективным для профилактики бактериально-ассоциативной респираторной инфекций цыплятбройлеров являлось использование настойки прополиса по схеме 2-й группы: выпаивание в дозе 1 мл/л воды в возрасте 1–5; 14–18; 25–30 дней в сочетании с аэрозольной обработкой (разведение 1:20, 0,5 л/100 м3 помещения, экспозиция 60 мин, один раз в день) на 1, 7, 14, 21–22, 28–29, 30–36-й день выращивания.
Применение разработанной схемы повышает эффективность профилактических мероприятий при респираторных инфекциях птиц бактериальной этиологии, увеличивает сохранность и продуктивность бройлеров, позволяет исключить применение антибиотиков в профилактических целях и получить экологически безопасную продукцию птицеводства.
ЗАКЛЮЧЕНИЕ
По результатам проведенной работы можно сделать следующие выводы:
1. Аэрозольное применение настойки прополиса снижает микробную обсемененность в воздухе залов с птицей 1-й и 2-й групп к 42 дням в сравнении с контролем КОЕ/м3 : ОМЧ – на 1109–1169, БГКП – на 108–122, численность стафилококков – на 132–141, энтерококков – на 120–122, микроскопических грибов – на 229–236, уменьшает количество патогенной и условно-патогенной микрофлоры в соскобах со слизистой оболочки гортани цыплят, что подтверждает бактерицидное действие прополиса на микрофлору воздуха и верхних дыхательных путей птицы.
2. Выпаивание настойки прополиса цыплятам 2-й группы способствовало активизации естественной резистентности и обмена веществ в их организме, о чем свидетельствовало повышение бактерицидной активности сыворотки крови в 42-дневном возрасте на 8,8 %, содержания в крови гемоглобина – на 20,3 г/л, эритроцитов – на 0,7×1012/л, общего белка – на 4,9 г/л и глобулинов – 5,3 г/л по сравнению с контрольной группой.
3. Наиболее эффективно для профилактики респираторных инфекций птиц применение настойки прополиса по схеме 2-й группы, т. е. аэрозольно в сочетании с выпаиванием без применения антибиотиков и дезинфектантов. Использование данной схемы позволяет повысить сохранность на 3,0 %, живую массу на – 342,7 г, исключить применение антибиотиков и получить экологически безопасную продукцию птицеводства.



