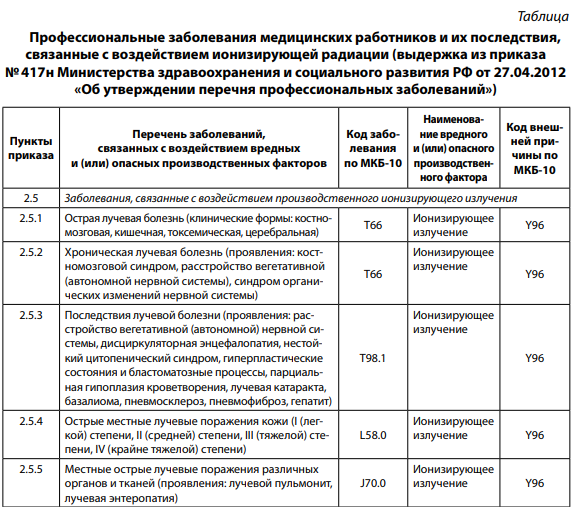
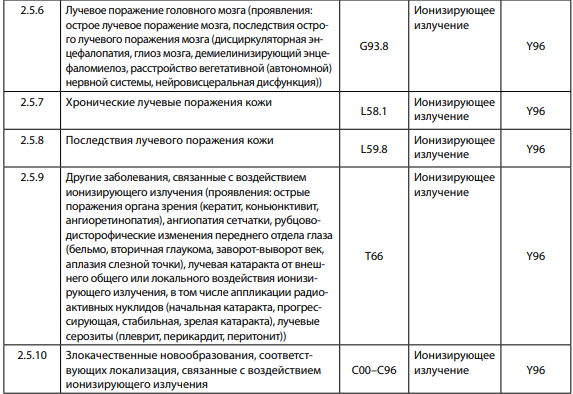
Среди вредных производственных факторов физической природы потенциально опасными факторами развития профессиональных заболеваний у медицинских работников прежде всего являются различные виды ионизирующего излучения, которые могут вызывать: лучевую болезнь, местные лучевые поражения, новообразования различных органов, опухоли кожи, лейкозы (таблица).
Патогенное влияние ионизирующей радиации на организм человека известно практически со времени ее применения в медицине. В 1896 году было открыто излучение естественных радионуклидов (альфа- и бета-частицы и гамма-лучи) французским исследователем А. Беккерелем. Он один из первых пострадал от действия радиации. В апреле 1902 г. Беккерель по просьбе Пьера Кюри приготовил препарат радия для демонстрации его свойств на конференции. Он положил стеклянную трубочку с препаратом в карман жилета, где она находилась почти 6 часов. Спустя 10 дней на коже под карманом появилась эритема, а еще через несколько дней образовалась язва, которая долго не заживала (Линденбратен Л. Д., Королюк И. П., 2000).
ЛУЧЕВАЯ БОЛЕЗНЬ И ЗЛОКАЧЕСТВЕННЫЕ НОВООБРАЗОВАНИЯ
Среди медицинских работников наиболее подвержены действию ионизирующего излучения те, кто обслуживает рентгеновские кабинеты, радиологические лаборатории, а также некоторые категории хирургов — рентгенохирургические бригады (Зольникова Н. И. и др., 1981; Королева Е. П., 2008). При частом выполнении подобных процедур рентгенологический контроль при которых связан с характером оперативного вмешательства, дозы облучения могут превышать допустимые (Кириллов В. Ф., 1982).
Установлены основные дозовые пределы облучения для организма в целом или отдельных органов. Они ориентированы на определенные контингенты, профессиональные группы. Биологическое действие ионизирующего излучения в первую очередь определяется величиной поглощенной дозы и наиболее заметно проявляется в активно пролифилирующих тканях (лимфоидная, кроветворная и др.), ему соответствует темп и выраженность изменений, например показателей периферической крови, широко используемых в диагнозе и прогнозе лучевой болезни (Ярмоненко С. П., 1998; Ильин Л. А., Кириллов В. Ф., Коренков И. П., 1996).
Лучевая болезнь является довольно редким проявлением воздействия ионизирующего излучения на медицинских работников. Как показывает наша практика, это последствия недостаточно регламентированных условий труда в послевоенные годы, когда еще только накапливался опыт в области радиационной гигиены и радиационной безопасности и медработники не знали средств защиты от вредного действия радиации. При длительном формировании общей пороговой дозы, сопоставимой по времени с продолжительностью профессиональной деятельности, а также при достижении определенного уровня доз может развиваться хроническая лучевая болезнь (Гуськова А. К., 1996).
Хроническая лучевая болезнь — это полиорганная патология, характеризующаяся длительностью и волнообразностью течения с проявлениями радиационного повреждения организма и его восстановительно-приспособительных реакций.
У медицинских работников при контакте с рентгенодиагностической, терапевтической аппаратурой вероятность патологической действия рентгеновского и гамма-излучения повышается в случаях недостаточной защиты трубки, пренебрежения средствами индивидуальной защиты, их изношенности или отсутствия, проблем с экранированием персонала. Клиника хронической лучевой болезни характеризуется определенной последовательностью развития патологических симптомов и синдромов (Шустов В. Я., Королев В. В., Ольховская А. Г., 1991; Гуськова А. К., 1996).
В доклинический период возможно появление отдельных признаков лучевого воздействия: астенические жалобы, нестойкая лейкоцитопения, неустойчивость артериального давления. Динамическое наблюдение (при отстранении от работы с радиацией) позволяет уточнить характер выявляемых изменений.
При легкой (I) степени хронической лучевой болезни (суммарная доза — 2,5–3,0 Зв) выявляются нарушения нервно-сосудистой регуляции. Больные жалуются на общую слабость, расстройства сна, головную боль, женщины — на нарушение менструаций. При объективном обследовании обнаруживаются признаки вегетативно-сосудистой дистонии: наклонность к гипотонии, акроцианоз, гипергидроз, повышенная гидрофильность кожи, спастическое состояние капилляров ногтевого ложа, сетчатки, снижение тургора кожи. Выражена лабильность гематологических показателей, но преобладает тенденция к развитию лейкопении, относительного лимфоцитоза, ретикулоцитоза. В периферической крови появляются единичные мегалобрасты. В костном мозге отмечаются раздражение клеток красного кровяного ростка, нарушение созревания нейтрофилов и увеличение количества плазмоцитов.
Средняя (II) степень тяжести лучевой болезни (суммарная доза облучения — 4–6,0 Зв) характеризуется стойкими изменениями со стороны перечисленных выше систем организма. Больные жалуются на головную боль, головокружение, значительное снижение работоспособности, тошноту. Типичными являются признаки вегетативно-висцерально-эндокринной дистонии: раздражительная слабость, тахикардия, ангионевротическая стенокардия, синусовая аритмия, гипотония, положительный глазосердечный рефлекс, нарушение моторики желудочно-кишечного тракта, гипосекреция желудка, гипергидроз, гиперпигментация, ломкость ногтей, понижение тургора кожи; у женщин могут появляться признаки вирилизма — грубый голос, оволосение лица. Иногда развивается диэнцефальный синдром, сопровождающийся чувством голода, страха, болями в области сердца, похуданием, сонливостью, периодически появляющимся субфибрилитетом, приступами пароксизмальной тахикардии. При объективном исследовании обращают на себя внимание петехиальная сыпь на коже, кровоточивость и разрыхление десен, ангиопатия сетчатки, признаки ускоренной инволюции органов зрения. В периферической крови обнаруживаются стойкая лейкопения, нейтропения, относительный лимфоцитоз, качественные изменения структуры ядра и протоплазмы клеток (фрагментация и полисегментация ядер, кариорексиз, пикноз, цитолиз и гипохромия клетки, вакуолизация цитоплазмы, мегалоцитоз и др.). В костном мозге отмечаются задержка созревания миелоцитарного ряда, угнетение эритропоэза, увеличение количества ретикулоцитарных и плазматических клеток, тромбоцитопения, развивается нормохромная анемия.
Тяжелая (III) степень хронической лучевой болезни отличается выраженными изменениями органического характера — атрофия слизистой оболочки желудочно-кишечного тракта, дистрофические и микроструктурные изменения в сосудистой системе, сердечной мышце, нервной системе и аплазия кроветворения. Больные адинамичны, жалуются на упорную головную боль, головокружение, рвоту, упорную бессонницу, потерю аппетита, носовые, десневые, маточные кровотечения, периодически теряют сознание.
При объективном исследовании выявляются признаки геморрагического синдрома, некротические процессы в полости рта, расшатывание и выпадение зубов. Со стороны сердечно-сосудистой системы определяются миокардиодистрофия, гипотония, аритмии, сердечная недостаточность. Изменения нервной системы проявляются в виде синдромов энцефалопатии или токсического энцефалита, атаксии, вестибулярных расстройств. Нарушается белковый, жировой, углеводный, минеральный обмен. При исследовании крови обнаруживаются выраженные стойкие лейкопения, лимфопения, тромбоцитопения, анемия, увеличение СОЭ. Со стороны клеток крови — выраженные дегенеративные изменения. В костном мозге — резкая гипоплазия с выраженной задержкой созревания костно-мозговых элементов, распадом клеток и патологическим митозом. Исход — полная аплазия костного мозга.
Критериями дифференциальной диагностики хронической лучевой болезни являются (Гуськова А. К., 1996):
1) связь клинических симптомов с периодом формирования основной доли лучевой нагрузки, их регресс при прекращении облучения;
2) развитие клинических синдромов поражения критических органов, характерных для данного вида радиационного воздействия (рак кожи рук рентгенологов и др.);
3) исключение предшествующих лучевой болезни общесоматических заболеваний со сходными клиническими проявлениями (лимфолейкоз у рентгенолога и пр.);
4) анализ влияния других (нелучевых) факторов труда и быта (экологические кацерогены, пестициды и пр.) или развитие заболеваний, этиологическая связь которых с данным типом лучевого воздействия научно не доказана (рак легких у рентгенологов, лейкоз при работе с радиоактивным йодом и пр.).
Лечение хронической лучевой болезни
Обязательное условие — прекращение контакта с ионизирующей радиацией и, при работе с открытыми источниками, выведение радиоактивных веществ из организма. С этой целью применяются комплексонообразователи — тетацин, пентацин, которые в виде 10 % растворов вводятся в вену по 20 мл с 5% раствором глюкозы (два раза в день в течение 4–5 дней). Через 4–5 дней возможен повторный курс лечения (целесообразно при попадании радиоизотопов внутрь). Больные с легкой степенью лучевой болезни при активном лечебно-оздоровительном режиме (лечебная физкультура, климатотерапия и пр.) должны избегать инсоляции. Им рекомендуются гальванотерапия, массаж, ультразвук, бальнеопроцедуры, сероводородные курорты (Серноводск, Сергиевские минеральные воды). При астеническом и неврастеническом синдромах применяются транквилизаторы, которые снимают беспокойство и страх, внутреннюю напряженность, тревогу, головную боль, а также некоторые вегетативные расстройства: диазепам 6–40 мг/сут в 1–4 приема, хлордиазепок-сил по 40 мг/сут, нитразепам по 2,5–25 мг/сут, тофизепам (грандаксин). Необходимо предостеречь больных от увлечения транквилизаторами, при длительном приеме они могут вызывать мышечную слабость, сонливость, редко атаксию (диазепам), половые расстройства (хлордиазепоксид), галлюцинации (нитразепам). Тофизепам лишен отмеченных побочных эффектов, но иногда (редко) дает синдром отмены.
При астении показаны раствор женьшеня по 30 капель два раза в сутки, китайского лимонника по 20 капель два раза в сутки, пантокрин по 20 капель два раза в сутки.
С учетом угрозы гипопластических состояний при лучевой болезни необходимо использовать гемостимулирующую терапию: переливание цельной крови или ее составных частей. Преимущество эритроцитарной массы перед цельной цитратной кровью состоит в том, что цитрат натрия снижает фагоцитарную активность лейкоцитов, обладает антикоагулирующими свойствами, кроме того, при переливании эритроцитарной массы реже возникают реакции белковой несовместимости. Переливание крови, эритроцитарной массы, плазмы осуществляется капельным способом: разовая доза эритроцитарной массы — 100–125 мл, глюкозоцитратной катионитной — 225–250 мл, плазмы — 50–125 мл. При выраженном геморрагическом синдроме показано переливание плазмы, обогащенной кровяными пластинками или пластиночного концентрата, а также тромбоцитарной массы. Тромбо-, лейкомасса вводится шприцем медленно, разовая доза, полученная из 450 мл крови, содержит 50–70 млрд тромбоцитов и около 2 млрд лейкоцитов. Реже используются кровезаменители — полиглюкин, аминопептид, поливинилпирролидон и др.
Для повышения регенераторных возможностей костного мозга применяют витамины группы В отдельными курсами по 6–8 недель: витамин В, по 1 мл 5 % раствора подкожно ежедневно; В2 — по 5 мг три раза в стуки внутрь; В6 — по 50 мг ежедневно внутримышечно; В12 — по 100 мг внутримышечно через день; фолиевая кислота — по 30 мг три раза в сутки внутрь, пантотеновая кислота — по 30 мг три раза в сутки внутрь. Курс лечения витаминами обычно повторяется 2–3 раза с промежутками в 10–15 дней. В качестве лейкостимуляторов назначают пентоксил по 0,2; 4-метилурацил по 0,5; лейкоген по 0,2; батилол по 0,2 два раза в сутки внутрь, а также 5% раствор натрия нуклеината по 2 мл внутримышечно.
При наличии у больных эритротромбоцитопенического синдрома показаны кортикостероидные препараты: преднизолон или преднизон до 20–40 мг в сутки, триамсинолон — 16–28 мг, дексаметазон — 3,75– 5,25 мг. Продолжительность курсов лечения — 3–10 недель. При необходимости курс терапии повторяют через 7–10 дней. С учетом катаболического влияния кортикостероидов вместе с ними назначают анаболические препараты — динабол, метилтестостерон и др.
Профилактика лучевой болезни
Это прежде всего строгое соблюдение правил техники безопасности, применение средств индивидуальной защиты, своевременное и тщательное прохождение периодических медицинских осмотров (динамика гемограммы!). На работу с источниками ионизирующего излучения не допускаются лица, имеющие следующие заболевания: органические поражения центральной нервной системы, эпилепсия, выраженные невротические и астенические состояния, эндокринопатии, заболевания половых желез и нарушения овариально-менструального цикла, дерматиты, катаракта, все болезни системы крови, а также вторичные анемии, геморрагический диатез, лейкопении, заболевания печени.
Обязательное условие эффективной терапии и прогноза жизни больных — прекращение работы с источниками радиации. БМСЭ устанавливает процент утраты профессиональной трудоспособности и компенсацию дополнительных расходов (лечение, в том числе и санаторно-курортное, дополнительное питание и пр.).
Профессиональные лейкозы
Доказано, что лейкозы могут развиваться у лиц, имеющих профессиональный контакт с ионизирующей радиацией. Лейкозы у лиц, имеющих профессиональный контакт с ионизирующим излучением (радиологи, сотрудники рентгенологических кабинетов), возникают обычно при несоблюдении мер защиты (Гладкова Е. В., Гурвич Е. Б., 1996).
Среди вариантов профессиональных лейкозов наиболее часто встречается миелолейкоз, нередко ему предшествуют цитопенические изменения крови. Профессиональную природу заболевания подтверждает длительный (чаще более 10 лет) стаж работы в контакте с ионизирующим излучением.
Острый миелобластный лейкоз — это злокачественное новообразование системы крови, состоящее из морфологически незрелых клеток миелоидного ряда. Клиника острого лейкоза характеризуется тремя основными синдромами: анемический, геморрагический и язвенно-некротический. Первые жалобы обычно на боли в горле, высокую лихорадку, затем появляется кровоточивость, вначале на слизистых оболочках (десны), а позднее обнаруживаются кожные геморрагические проявления, гнойно-некротические изменения в горле, петехии и экхимозы на коже. В крови отмечаются увеличение числа лейкоцитов, бластные и полностью дифференцированные клетки, переходных форм нет (лейкемический провал). Идентификация лейкоза проводится по клеточному типу, определение которого возможно только в специализированных клиниках цитохимическими методами. Здесь же проводится лечение по программам, разработанным для каждого клеточного типа рака. Все больные острым лейкозом нетрудоспособны. МСЭ устанавливает пациентам также необходимость в дополнительных видах компенсации ущерба здоровью (лекарства, дополнительное питание, уход и др.). В случае смерти больного компенсация ущерба распространяется на его иждивенцев.
Хронический миелолейкоз
Ему свойственно изменение кроветворения в виде гиперпролиферации и нарушения дифференциации на уровне промиелоцитов и миелоцитов. По мере развития процесса подавляется эритробластический росток костного мозга, а миелопоэз и мегакариоцитарный ростки расширяются, миелоидные инфильтраты выходят за пределы костного мозга и развиваются в селезенке и печени. При прогрессировании болезни, резистентности к терапии проявляется тенденция к дифференциации миелоидных элементов вплоть до гемоцитобластов и ретикулярных клеток, т. е. заболевание приобретает черты острого лейкоза.
В начале заболевания больные чувствуют себя вполне удовлетворительно. Могут быть жалобы на небольшую слабость. Диагноз устанавливается при очередном или случайном исследовании крови: лейкоцитоз (15–20×109 /л) со сдвигом в гемограмме до миелоцитов. Постепенно увеличиваются размеры селезенки, развивается общая слабость, периодически повышается температура. Развивается функциональная недостаточность печени, почек, сердца, связанная с измененными условиями кровообращения и питания, иногда с лейкозной инфильтрацией и этих органах. В крови часто неуклонно увеличивается количество лейкоцитов, в основном незрелых гранулоцитов, нарастает анемия, развивается в одних случаях тромбоцитоз, в других — тромбоцитопения с соответствующими осложнениями. У отдельных больных количество лейкоцитов в периферической крови на весь период болезни остается на сублейкемическом уровне (60–75×109 /л), часто это сочетается с выраженной спленомегалией. Постепенно нарастает истощение, связанное с лейкозной интоксикацией и белковой недостаточностью, активируются хронические инфекции. Период развернутых клинических проявлений сменяется третьим, терминальным периодом, когда клеточная аплазия выражена максимально. Состав крови характеризуется преобладанием среди ядерных форм гемоцитобластов и миелобластов, выраженной анемией и тромбоцитопенией. Пункция костного мозга обнаруживает почти полное его гемоцитобластное превращение. Нарастают интоксикация, истощение, септические состояния, недостаточность внутренних органов.
Клинический пример
Больной Б-ов, 38 лет, врач-рентгенолог. Из профанамнеза: после окончания института все время работал врачом-рентгенологом в различных рентгенодиагностических кабинетах. Средствами индивидуальной защиты (фартук, перчатки) пользовался не всегда. При обследовании рабочего места обнаружены дефекты изоляции кабинета и других рабочих помещений, где Б-ов занимался оформлением рентгенологической документации. Профосмотры проходили формально, иногда гемограмму составлял сам больной. Через 12 лет работы стало беспокоить снижение работоспособности, при исследовании крови обнаружен значительный лейкоцитоз — 25×109 /л со сдвигом в гемограмме влево. При обследовании в специализированном гематологическом отделении выявлен хронический миелолейкоз. Для определения связи заболевания с профессией направлен в профцентр с диагнозом: хронический миелолейкоз. ВК профцентра дала заключение о профессиональном генезе заболевания. Пациент направлен на БМСЭ с соответствующими рекомендациями, а затем для дальнейшего обследования и лечения — в федеральный центр профпатологии.
Лечение: при хроническом миелолейкозе фармакотерапию начинают как можно раньше, еще до развернутой формы заболевания. Специфическую химиотерапию проводит гематолог в стационаре или амбулаторно. Назначается миелосан по 2–6 мг/сут в зависимости от количества лейкоцитов: до 50×109 /л — 2 мг/сут, 50–100×109 /л — 4 мг/сут, более 100×109 /л — 6 мг/сут. При уменьшении количества лейкоцитов вдвое от исходного уровня доза миелосана уменьшается в 2 раза. При стабилизации процесса (лейкоциты на уровне 15–20×109 /л) необходима поддерживающая доза миелосана 2 мг один раз в неделю. В целом прогноз неблагоприятный.
Радиационное воздействие может вызывать и другую форму лейкоза — лимфогранулематоз (болезнь Ходжкина). Это тяжелое общее заболевание, протекающее с опухолевидным разрастанием лимфатических узлов и симптомами интоксикации (лихорадка, зуд кожи, кахексия). Патологоанатомически лимфогрануломатоз характеризуется развитием узелковых разрастаний в лимфатических узлах, селезенке, печени, костном мозге и других органах. Чаще всего заболевание начинается с увеличением шейных лимфатических узлов, сначала они эластичны, но затем уплотняются, спаиваются между собой, образуя опухолевые конгломераты. К числу важнейших клинических симптомов относятся: повышение температуры, потливость, кожный зуд. При генерализации процесса происходит вовлечение новых групп лимфатических узлов, а также распространение процесса на внутренние органы, увеличивается селезенка. Причем при генерализованном процессе это увеличение незначительно, а при изолированном — чаще наоборот. Последняя форма протекает благоприятнее и длительнее других. В пунктах лимфатических узлов, селезенки, как правило, обнаруживаются клетки Березовского — Штернберга. Клиническая картина заболевания во многом определяется характером и степенью поражения внутренних органов и систем: желудочно-кишечного тракта — диспептические явления, кровотечения, язвы; органов дыхания — перифокальные пневмонии, образование полостей в легких, плевриты, легочные кровотечения; поджелудочной железы — симптомы сахарного диабета и т. д. Изменения лейкограммы характеризуются нейтрофилезом со сдвигом влево, лимфоцитопенией, эозинофилией и моноцитозом. Общее число лейкоцитов может быть повышено, а может оставаться нормальным, особенно в начале болезни. СОЭ увеличена. Нарастание клинических явлений сопровождается прогрессированием анемии. Лечение назначают в зависимости от стадии болезни.
Клинический пример
Больной М-ч, 54 лет, рентгенолаборант. Профессиональный анамнез: с 21 года работал в рентгеноперационной, выполняя сложные рентгено-контрастные исследования, в том числе зондирование сердечно-сосудистой системы. Радиационный фон во время исследований был повышен. Основную работу постоянно совмещал с выполнением должности рентгенолаборанта в других медицинских учреждениях. Длительное время по совместительству работал на гамма-терапевтических аппаратах. Так продолжалось до возраста 51 года, когда появились высокая температура (38°С), слабость, тупые боли в животе. При обследовании (диагностическая лапоротомия) обнаружено увеличение лимфатических узлов брюшной полости. В 52 года произведена спленэктомия. В течение трех лет лечился в г. Обнинске: химиотерапия и лучевая терапия. Чувствовал себя удовлетворительно. Поступил в клинику профзаболеваний в возрасте 54 года с жалобами на зуд в паховой области, увеличение паховых лимфоузлов, повышение температуры до 38 °С в течение 20 дней. В день поступления произведено иссечение двух паховых лимфоузлов размерами 2,5×2,0 см. При объективном исследовании увеличения других групп лимфатических узлов не выявлено. Кожа — бледно-землистая, АД — 150/90 мм рт. ст., печень не пальпируется. Гемограмма: Э — 2,8×1012/л, Нв — 95 г/л, ЦП — 0,67; тромбоциты — 100 тыс.; лейкоциты — 4,0×109 , Э — 1, миелоциты — 2, 10–, П — 6, С — 63, Л — 13, М — 3, СОЭ — 10 мм/ч, умеренный анизоцитоз, незначительный пойкилоцитоз. Консультация гематолога: лимфогранулематоз, обострение. В течение месяца проводилось стационарное лечение цитостатиками (адриабластин, винкристин, циклофосфан) и преднизолоном. Состояние больного несколько улучшилось, уменьшилась выраженность анемии (при выписке эритроцитов — 3,72×1012/л). Но вскоре наступило резкое ухудшение с выраженными явлениями общей интоксикации, связанной с основным заболеванием, наступил летальный исход.
Экспертиза трудоспособности: больные нетрудоспособны, при профессиональном генезе заболевания направляются на БМСЭ, где устанавливается инвалидность и процент утраты профессиональной трудоспособности, а также другие виды возмещения ущерба, предусмотренные постановлением Правительства РФ. В случае смерти профессионального больного ущерб возмещается иждивенцам.
Профилактика профессионального рака, вызванного ионизирующей радиацией у медицинских работников, включает в себя первичные и вторичные мероприятия. Первичная профилактика предусматривает предупреждение возможности возникновения рака и включает в себя гигиеническое регламентирование воздействия, разработку и осуществление мероприятий, направленных на уменьшение интенсивности источника, контроль за состояние производственной среды (особенно при работе с открытыми источниками), запрещение работать с ионизирующими источниками людям, имеющим наследственную предрасположенность к опухолевым заболеваниям, а также с хромосомной нестабильностью, выявление лиц с иммунологической недостаточностью и проведение среди них мероприятий для нормализации иммунного статуса, применение препаратов, предотвращающих бластомогенный эффект (т. е. методы гигиенической, генетической, иммуннологической и биохимической профилактики).
Существенное значение имеет и диспансеризация лиц, работающих с источниками ионизирующего излучения, раннее выявление и лечение хронических фоновых и предопухолевых заболеваний, т. е. своевременное и качественное проведение медицинских осмотров. Контроль за состоянием здоровья работающих с канцерогенными факторами должен осуществляться и после ухода медработников на другую работу, а также на пенсию, т. е. в течение всей жизни (Пылев Л. Н., 1986).


