Пирролохинолинхинон (pQQ) был открыт в 1979 г. как новый кофактор ряда бактериальных окислительно-восстановительных ферментов [1], относящихся к хинопротеинам [2]. Во многих прокариотических системах pQQ функционирует как компонент различных глюкозо- и алкогольдегидрогеназ представленных в различных микроорганизмах. В животных тканях pQQ является кофактором ряда окислительно-восстановительных ферментов: лизилоксидазы аорты быка, диаминооксидазы плазмы крови быка, диаминооксидазы почек свиньи, адреналовой допамин гидроксилазы быка, ДОПА-декарбоксилаза почек свиньи, лизилоксидазы плаценты человека, и в этом плане может рассматриваться как витамин.
pQQ как кофермент входит в структуру более 20 соответствующих ферментов микроорганизмов, грибов, различных растительных и животных тканей [3], однако способен функционировать и как самостоятельный микронутриент, о чем сообщается в ряде источников [1–3] (табл. 1, 2).
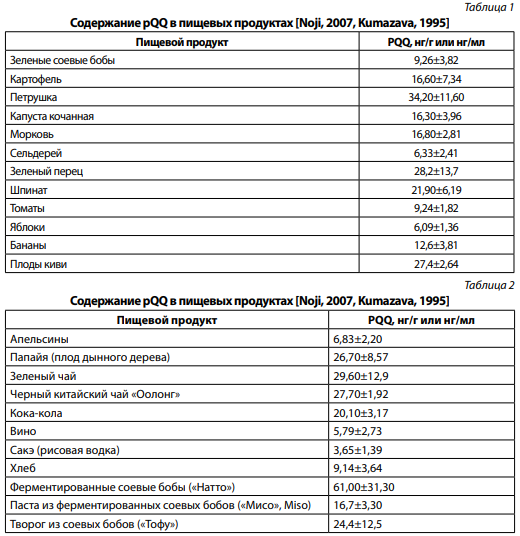
Необходимо обратить внимание на особенно высокое содержание pQQ в зернах какао, составляющее 0,34–0,76 мкг или 340–760 нг/г продукта. Наличие pQQ в клетках и жидкостях организма человека не вызывает сомнений, однако его средняя тканевая концентрация весьма низка и составляет, по мнению профессора Rucker с соавторами, всего 10% уровня, обнаруженных в пищевых растениях. Это означает, что при их поступлении в организм потребность организма в pQQ может быть легко удовлетворена и тем самым предотвращен его тканевой дефицит. Это означает, что включение в рацион соответствующих растительных источников pQQ является обязательным, что заставляет рассматривать их как незаменимые компоненты питания, поскольку нормальная кишечная микрофлора человека не продуцирует pQQ и не может покрывать потребность в нем [4].
Следует особо подчеркнуть факт уникально высокого содержания pQQ и его форм в женском молоке (~140–180 нг/мл), что уже само по себе свидетельствует о значимости этого вещества для быстро растущего и развивающегося организма грудного ребенка (для сравнения отметим, что его содержание в коровьем молоке составляет 3–4 нг/мл). Указанный факт должен быть учтен при производстве заменителей материнского молока при искусственном вскармливании новорожденных, а высокое содержание этого компонента в зернах какао — в системе детского питания, в том числе школьного.
Химически pQQ представляет собой полициклическую сопряженную систему, весьма устойчивую термически и химически, что существенно сказывается на его важнейших биохимических свойствах, прежде всего митохондриорегулирующих и антиоксидантных. Причем динатриевая соль хорошо растворима в воде и, соответственно, в плазме крови. Химические свойства pQQ, которые в большой степени влияют и на биологические, определяются наличием в молекуле орто-хиноновой группировки, находящейся под влиянием пиридинового и пиррольного атомов азота и трех карбоксилатных групп. Важной особенностью pQQ является способность легко, неферментативно восстанавливаться в водной среде аскорбиновой кислотой и другими восстановителями до пирролохинолинхинола, в отличие от убихинона (кофермента Q10) и других хинонов, что, как будет сказано ниже, определяет антиоксидантные свойства этого микронутриента.
Уникальность молекулы pQQ состоит в том, что в одной молекуле представлена комбинация свойств аскорбиновой кислоты (восстановительный потенциал), рибофлавина (редокс-реакции) и пиридоксаля (карбонильная реакционная способность). Иллюстрацией сказанному является тот факт, что pQQ может служить высокоактивным субстратом эритроцитарной витамин В2-зависимой редуктазы (флавинредуктазы), намного более активным, чем витамин В2 (Hulquist, 1993). Образующаяся в этой реакции восстановленная форма pQQ — пирролохинолинхинол — взаимодействует с радикалом феррилмиоглобина в сердечной мышце, защищая ее от повреждения при реоксигенации (Xu, 1993). Окисление аминокислоты лизина в белках соединительной ткани эластине и коллагене в присутствии ионов меди Cu++ (соотношение pQQ/ Cu++ 2:1) приводит, как и в случае известной комбинации витамина В6 и ионов Cu++, к формированию поперечных сшивок, что наводит на мысль о роли pQQ материнского молока в созревании коллагена соединительной ткани растущего организма младенцев при грудном вскармливании, а также в регенеративных процессах [4].

Интригующей была попытка рассматривать pQQ как новый витамин (ему было даже присвоено название — витамин В14), однако на сегодняшний день принята точка зрения о роли pQQ, по крайней мере в организме человека, как биологически активного микронутриента [4]. Исследование функций pQQ на экспериментальных моделях позволили установить, что его дефицит в организме приводит к ряду серьезных системных нарушений, включающих нарушения роста, репродуктивной функции, иммунного статуса [5]. Несомненно, эта проблема непосредственно связана с характером и режимом питания, так как все указанные показатели заметно снижены у животных, находящихся на диете, лишенной pQQ. Добавление даже 300 mг pQQ на килограмм не содержащей его диеты улучшает репродуктивную функцию и повышает скорость неонатального роста и иммунитета крыс и мышей по сравнению с пищей, лишенной этого компонента [6]. В дозе 3 мг на килограмм веса тела грызунов pQQ обеспечивает защиту тканей сердца и мозга от ишемии (Zhu B.Q., 2006, 2004). Tao R., в 2007 году показал на культуре человеческих фибробластов, что pQQ и IPQ увеличивают рост клеток и их пролиферацию. Многоплановое влияние pQQ на важнейшие физиологические функции организма обусловлено наличием у этого вещества ряда уникальных свойств, важных для роста, развития и даже выживания организмов.
Ключевым свойством pQQ является его способность активировать в клетках митохондриогенез, т. е. образование новых, неповрежденных и, соответственно, немутированных митохондрий.
Функция pQQ как индуктора митохондриогенеза была показана в работах Misra H., 2012, Harris K., 2013, Rucker R., 2009, а данные по механизму этого процесса были получены в работе W. Chowanadisai с соавт. [8] на культуре клеток гепатоцитов мышей. Воздействие на эти клетки даже 10–30 mm pQQ в течение 24–48 часов однозначно продемонстрировало увеличение активности маркерных ферментов митохондриогенеза — цитратсинтазы, цитохром-С-оксидазы и повышение интенсивности утилизации кислорода клетками, более выраженное при увеличении времени экспозиции. Одновременно было показано повышение содержания этих ферментов путем изучения соотношения мтДНК/ядДНК, возрастающее под влиянием pQQ. pQQ-дефицитные взрослые крысы и мыши характеризуются 20–30%-ным уменьшением количества митохондрий в клетках печени и сердца, снижением показателей тканевого дыхания по сравнению с pQQ обеспеченными животными. Аналогичная картина наблюдалась у взрослых мышей. При этом количество митохондрий в клетках животных, получавших pQQ (2 мг/кг диеты), возрастало на 150% по сравнению с pQQ-дефицитными при одновременном увеличении размера митохондрий. Таким образом, pQQ активно влияет на митохондриогенез у перинатальных и созревающих животных и является, по-видимому, важным фактором онтогенеза.
Еще одним показателем воздействия pQQ на митохондрии являются данные по влиянию на клеточную выживаемость в условиях подавления клеточного дыхания митохондриальными ядами — ротеноном, антимицином А и азидом натрия, действующими на разные звенья дыхательной цепи митохондрий. Клетки, экспонированные pQQ за 24 часа до воздействия ингибиторов, демонстрируют повышенную клеточную выживаемость по сравнению с системами без pQQ. Клетки, экспонированные pQQ перед воздействием ротенона, характеризуются большим уровнем поглощения кислорода с одновременным снижением продукции супероксиданион радикала О2, чем клетки, экспонированные ротеноном без pQQ [9]. Приведенные данные наводят на мысль о возможности использовать pQQ для защиты от токсического действия митохондриальных ядов техногенного характера, а также снижения побочных эффектов лекарственных препаратов, подавляющих функционирование дыхательных цепей митохондрий, например барбитуратов. Митохондриальный биогенез индуцируют и другие природные вещества и их комбинации, входящие в современную систему питания. Это было показано для кверцетина, резвератролов, гидрокситирозола, эпикатехолгаллат, комбинации R-a-липоевой кислоты, биотина, ацетил-L-карнитина и никотинамида, разветвленных аминокислот валина, лейцина, изолейцина, которые стимулируют мито-хондриогенез и/или улучшают функции митохондрий. Однако активные дозы указанных веществ намного превышают таковые для pQQ. Так, резвератрол усиливает митохондриогенез у животных в дозах 200–500 мг/кг вес, что в 100 раз выше, чем в обычной дозе красного вина, которое рассматривается как доступный источник этого нутриента. Что же касается pQQ, то уже доза 0,2–0,3 мг (т. е. в тысячу раз более низкая) эффективно воздействует на рост и развитие мышей. Это соответствует ½ дозе фолиевой кислоты (0,4–0,5 мг/кг веса) для этих животных, что равно содержанию pQQ в молоке человека [10].
Как следствие митохондриальных нарушений у pQQ-дефицитных животных имеют место изменения и других видов метаболизма, в частности обмена аминокислот и липидов, в том числе в липидном профиле крови, выражающиеся в 20–50% более низком уровне ди- и триглицеридов (т. е. жиров) по сравнению с кровью животных, не получавших pQQ. Повышение уровня триглицеридов в экспериментах с дефицитом pQQ коррелирует со снижением плотности митохондрий (на 20–30%) в сердечных и печеночных клетках и 50%-ным снижением m-РНК, соответствующей белку, связывающему и транспортирующему в митохондрии длинноцепочечные жирные кислоты, а также m-РНК, отвечающей ферменту окислительного метаболизма — ацил-КоА оксидазе. Соответственно, имеющее место при этом снижение интенсивности митохондриального b-окисления высших жирных кислот (это основной путь их энергетического превращения) является метаболическим доказательством влияния pQQ на энергетический метаболизм [11].
В то же время изменение в pQQ-статусе крыс не влияет на уровень свободных жирных кислот с длиной цепи > 20 атомов углерода, активность ферментов элонгации и десатурации и соотношение w-6/w-3 полиненасыщенных жирных кислот, что, вероятно, исключает вопрос о влиянии pQQ через эйкозаноидный (простагландиновый) путь. Что касается модуляции в содержании глюкозы и инсулина в плазме крови, отмечается умеренное воздействие pQQ на эти показатели, но не исключается повышение эффективности при более высоких концентрациях. В исследованиях Harris с сотр. впервые была проведена оценка влияния pQQ на оксидативный метаболизм и антиоксидантный потенциал человека, основанная на изменении метаболитов мочи при краткосрочном и длительном приеме pQQ. Используя определение тиобарбитурат активных продуктов (TBAR) в качестве показателей образования активных продуктов окисления, было показано, что значения D TBAR (0 час TBAR — 48 часов TBAR) коррелирует с пиковой концентрацией pQQ в плазме крови, что свидетельствует о влиянии pQQ на окислительный метаболизм и его антиоксидантном действии в наномолекулярных концентрациях, т. е. на порядок более низких, чем, например, катехинов [12]. Важные данные были получены по влиянию pQQ на метаболизм метилированных аминов — в основном продуктов кишечного микробного метаболизма, которые трансформируются в конечном счете до триметиламин-N-оксида (TMAO), избыточное образование которого является фактором риска развития и уринарным маркером атеросклероза, диабета и возмущений в липидном обмене, а также имеет место при микробной трансформации L-карнитина. У животных уровень ТМАО под действием pQQ снижается почти троекратно. Этот результат имеет важное значение при клиническом и спортивном применении L-карнитина для снятия побочных действий, обусловленных образованием в кишечнике под действием микрофлоры опасных N-оксидов. Механизм митохондриогенеза весьма сложен и представляет собой координированный биосинтез и импорт из цитозоля примерно 1000–1500 белков, кодируемых ядерным геномом и митохондриальной ДНК, синтезируемых цитозольными рибосомами, а также при участии белковых систем митохондриального трансмембранного транспорта. Тем не менее столь сложный процесс митохондриогенеза может быть запущен под действием не только комплекса факторов физической нагрузки, но и отдельными веществами, как синтетическими (метформин), так и природными, включая упомянутые выше резвератрол, ацетил-L-карнитин, гидрокситирозол и особенно pQQ. Механизм митохондриогенеза под влиянием pQQ многовекторный, включает ряд ключевых внутриклеточных регуляторных путей и осуществляется через ряд важных, но не единственных сигнальных систем [13]:
• специфический рецептор PGC — 1a, который называется «пероксисомальный пролифератор — активированный рецептор — g-коактиватор 1a»;
• ядерные респираторные факторы NRF;
• DJ-1 — фактор клеточной регуляции и ассоциированные с ним дополнительные факторы клеточной сигнализации. Это обусловлено не только необычными антиоксидантными свойствами pQQ (см. ниже), но и его способностью выступать в качестве сигнальной молекулы, модулирующей экспрессию многочисленных генов, включающих образование целых внутриклеточных компартментов, даже таких сложных, как митохондрии;
• PGC-1a — рецепторный белок с молекулярной массой 78 KDa. Соответствующий ему ген локализован в хромосоме в области, которая ассоциирована с базовыми уровнями инсулина, абдоминального подкожного жира и ожирения.
Экспрессия RGC-1a повышает чувствительность клеток к инсулину, и поэтому при диабете и преддиабете наблюдается снижение экспрессии RGC-1a. PGC-1a контролирует гены, включающие энергетический метаболизм, а также обеспечивает прямую связь между внешними физиологическими стимулами (например, физической нагрузкой) и митохондриогенезом. Его влияние является многоплановым и охватывает широкую сеть важнейших внутриклеточных регуляторных систем, включая рецепторы тиреоидных гормонов, кортикоидные, эстрогеновые (ER) и эстрогенсвязанные рецепторы (ERR).
PGC-1a через ERR выступает промотором окисления жирных кислот, промотором утилизации глюкозы, окислительного фосфорилирования, ангиогенеза. ERR являются орфановыми ядерными рецепторами, которые охватывают широкие генные сети, включенные во все аспекты энергетического гомеостаза, в том числе метаболизм жиров и глюкозы, так же как митохондриальный биогенез и митохондриальные функции [14]. По другому регуляторному пути pQQ влияет на активность фактора DJ-1, который регулирует ответ клетки на оксидативный стресс, что в комбинации с модуляцией других регуляторных сигнальных путей активно влияет на процессы выживаемости клеток и клеточного апоптоза. Мутации в DJ-1 могут приводить к болезни Паркинсона. Весь этот комплекс свойств обусловлен не только необычными антиоксидантными функциями pQQ, но и его способностью выступать в качестве регуляторной молекулы, модулирующей экспрессию целых сетей многочисленных генов, отвечающих образованию внутриклеточных компартментов, даже таких сложных, как митохондрии. Интеграция вышеназванных сигнальных путей и определяет влияние pQQ на клеточную пролиферацию, оксидативный метаболизм, митохондриогенез и апоптоз, предотвращение воспаления и некроза. Активность RGC-1a определяется не только экспрессией его уровня, но и последующими (посттрансляционными) ковалентными модификациями — фосфорилированием, ацетилированием и метилированием, существенно расширяющими спектр и характер активности PGC-1a и определяющими метаболический статус клеток и их адаптацию к внешним факторам. В этом аспекте важную роль играют две группы ферментов: 5`-АМФ-активированные протеинкиназы (АМРК) и сиртуины (SIRT) [15].
Антиоксидантно-прооксидантные свойства pQQ, как и других хинонов (убихинон, витамины К и др.), предопределяются структурой и в первую очередь возможностью функционирования в качестве окислительно-восстановительной пары: хинон-хинол. При этом хиноновая форма обладает свойствами окислителя и как антиоксидант функционировать принципиально не может. Антиоксидантные функции свойственны только восстановленным, фенольным формам. И здесь важно отметить, что особенностью pQQ является его способность в анаэробных условиях неферментативно легко восстанавливаться аскорбиновой кислотой, глутатионом, цистеином в водной среде при рН 7.4 (следовательно, и плазме крови) с количественным образованием восстановленной, фенольной формы pQQH2.
В противоположность pQQ митохондриальный хинон — убихинон (КоQ10) — в водной среде ни одним из указанных восстановителей не восстанавливается до убихинола и только в митохондриях имеет место ферментативный процесс восстановления и формирования пары убихинон КоQ10 — убихинол КоQ10H2. Поэтому когда речь идет об антиоксидантных свойствах любых хинонов, в том числе pQQ или КоQ, то на самом деле это касается только восстановленных, т. е. фенольных, форм.
Именно для pQQH2 установлена высокая антирадикальная активность в модельной реакции со стабильным свободным радикалом — моделью липоксильного радикала LOO, превосходящая активность витамина С почти на порядок, а глютатиона — на четыре порядка. В то же время активность окисленной формы pQQ в этой реакции практически отсутствует.
Важным аспектом проявления активности pQQH2 является его способность стимулировать превращение весьма токсичного синглетного кислорода 1О2 в обычный (т. е. триплетный 3О2) путем физического рассеивания его энергии практически без затрат самого антиоксиданта. В указанном аспекте действие pQQH2 аналогично таковому для каротиноидов.
Не менее важной для проявления защитных функций pQQ (естественно, в форме pQQH2) на системы организма является его способность выступать в качестве ловушки супероксиданион-радикала О2- и гидроксил-радикала ОН, а также ингибировать in vitro перекисное окисление липидов [12], включая защиту изолированного сердца от повреждения при реконвалесценции [13], ингибирование меланогенеза крайне агрессивных клеток меланомы, повышение продукции фактора роста нервов. На животных моделях было показано, что высокие дозы pQQ защищают ткани от повреждающего действия гипоксии — ишемии, индуцированного воспаления, повреждений печени, обусловленных этанолом и четыреххлористым углеродом [11, 14], формирования катаракты [14]. Он тормозит снижение уровня восстановленного глутатиона (показано на эмбрионах цыплят), обусловленное глюкокортикоидами [14, 15], способствует снижению смертности, индуцированной эндотоксином [16].
Однако уникальным свойством pQQ является не только высокая и многоплановая активность как антиоксиданта, но и эффективность его антиоксидантного действия, обусловленная способностью многократно, до 20 000 раз, регенерироваться и функционировать в редокс-системах в качестве самообновляющейся, регенерирующейся редокс-пары типа «хинон-хинол» без распада, что объясняется высокой химической стабильностью его циклической молекулы, тогда как малостабильный витамин С может регенерироваться всего четыре раза, т. е. в 5000 раз меньше.
Эффективность такого рециклизирующего механизма такова, что пикомолярные количества pQQ способны генерировать микромолярные количества продукта. Другие широкоизвестные, более стабильные, чем витамин С, антиоксиданты также значительно уступают pQQ Н2 по эффективности: так, эпикатехин шоколада — в 175 раз, кверцетин зеленого чая, фруктов и овощей — в 200 раз.
В молярном отношении pQQ как антиоксидант в 100 раз более эффективен, чем аскорбиновая кислота, все флавоноиды и другие полифенолы. Учитывая отмеченную выше способность pQQ в физиологических условиях восстанавливаться аскорбиновой кислотой до pQQH2, эту комбинацию можно рассматривать как перспективный синергистически действующий антиоксидантный комплекс. Высокая антиоксидантная активность pQQН2 и механизм редокс-циклирования pQQ имеет особое значение для защиты митохондриальной ДНК и митохондрий в целом от перекисного повреждения, а следовательно, мутационных изменений митохондриального генома, поскольку последний ферментативно защищен в значительно меньшей степени, чем геном клеточного ядра [17]. Поскольку именно митохондрии являются основным источником активных форм кислорода в клетке, значимость этой функции pQQ трудно переоценить, так как нарушения структуры митохондриальной ДНК и обусловленные этим мутации ассоциируются с развитием митохондриальных болезней, в том числе сердечных, нейротрофических и нейродегенеративных: болезни Альцгеймера, Паркинсона и т. д. Еще одним широким аспектом действия pQQ является окислительно-восстановительная модификация, а следовательно, регуляция активности ряда важных сигнальных, т. е. регулирующих, систем клетки, в частности активации ряда рецепторов (рецептора фактора роста эпидермиса, N-метил-D-аспартатного (NMDA) рецептора клеток нервной системы и мозга и т. д.). Особого внимания заслуживает способность pQQ нейтрализовать действие на клеточные системы одного из наиболее токсичных продуктов свободно-радикальных процессов в клетке — пероксинитрит-аниона ONOO-. Последний образуется путем неконтролируемо высокой скорости взаимодействия двух свободных радикалов — супероксид-анион радикала О2- и оксида азота NO. Он является одним из самых сильных окислителей и одновременно нитрующим агентом (т. е. вводит нитрогруппу в другую молекулу), в силу чего активно повреждает клеточные структуры, повреждает и нитрует белковые молекулы, приводя к образованию в них 3-нитротирозина (в нормальных белках он всегда отсутствует), который определяется как маркер так называемого нитросативного стресса. По существу, имеет место комбинация классического оксидативного стресса (за счет активных форм кислорода, например супероксидрадикала и др.) с нитросативным (азотистые окислители). Пероксинитрит провоцирует развитие миокардиального воспаления, обусловливает повреждение ДНК, приводит к энергетическому дефициту, в том числе снижению уровня важного для сердечной мышцы макроэрга креатинфосфата [18].
Нитросативный стресс лежит в основе крайне опасного для состояния сердца так называемого синдрома Такоцубо, который отражает катехоламин-индуцированное пролонгированное миокардиальное воспаление, а также нарушение энергетики сердечной мышцы. В целом генерация пероксинитрита in vivo представляет собой важнейший патогенный механизм при таких состояниях, как инсульт, инфаркт миокарда, хроническая сердечная недостаточность, диабет, циркуляторный шок, хронические воспалительные заболевания, рак и нейродегенеративные расстройства. pQQ существенно снижает токсическое действие пероксинитрита, а поскольку в организме отсутствуют системы, прежде всего ферментативные, нейтрализации этого метаболического токсиканта, pQQ представляет большой интерес как с точки зрения профилактики, так и в лечебном плане при этих заболеваниях, в том числе нитросативном стрессе, следствием которого являются сосудистые повреждения, нейропатологии, повреждения бета-клеток островков Лангерганса, а также различные иммуновоспалительные процессы. Нейтрализуя этот весьма токсичный агент, pQQ проявляет многоплановое защитное действие на различные системы организма.
Установлено, что нейтрализация пероксинитрита под действием pQQ (разумеется, в форме pQQН2) происходит не путем их прямого взаимодействия, а через активную нейтрализацию супероксид-анион радикала О2- практически без образования пероксида водорода, что особенно важно при гиперпродукции О2-, например при стрессе, и отсутствии влияния на оксид азота и все проявления его биологической активности.
Поэтому новые фармакологические стратегии, направленные на удаление пероксинитрита или подавление его образования, могут представлять собой перспективные терапевтические инструменты. К таковым может быть отнесен и pQQ, и продукты на его основе. Нейтрализуя активность этого весьма токсичного агента, pQQ проявляет многоплановое защитное действие, которое в сочетании со стимуляцией митохондриогенеза делает его весьма перспективным лечебно-профилактическим природным фактором, лишенным токсических и побочных эффектов, в кардиологии, неврологии, эндокринологии и т. д. Описанные выше уникальные биохимические свойства pQQ предопределяют его благоприятные фармакологические эффекты. Рассмотрим некоторые из них.
• pQQ при болезни Альцгеймера и других нарушениях памяти
• pQQ оказывает нейропротекторное влияние при болезни Альцгеймера, препятствуя развитию окислительного стресса, в том числе нитросативного, образованию конъюгатов амилоидных белков, внутриклеточное накопление которых приводит к дисфункции митохондрий. Стимулирующее влияние pQQ на митохондриогенез также может рассматриваться как важный превентивный эффект продукта.
• pQQ ингибирует образование амилоидных фибрилл A — β1–4 липофусцина, повреждающее действие которых на клетки мозга рассматривается как важная причина болезни Альцгеймера. pQQ стимулирует продукцию в клетках нервной системы фактора роста нервов, который функционирует как нейротропный фактор. Последний активирует функцию нейронов и предотвращает их гибель, способствуя улучшению памяти и познавательной активности и препятствуя возрастным нарушениям памяти, в том числе развитию болезни Альцгеймера. Установлена эффективность pQQ как фактора, повышающего когнитивные способности, способность к обучению и сохранению этих способностей даже в жестких условиях оксидативного стресса. pQQ способствует сохранению и восстановлению памяти и когнитивных функций, в том числе при черепно-мозговых травмах, а также может влиять на генерацию противовоспалительных медиаторов, в том числе цитокинов и простагландинов в процессе старения.
• pQQ при болезни Паркинсона
Это заболевание ассоциируется с формированием в мозгу телец Леви. Последние включают белок альфа-синуклеин (a-Syn), который при этой болезни аномально агрегирован и повреждает дофаминэргические рецепторы мозга. pQQ предотвращает такую агрегацию. В этом процессе важное значение имеет и активизация повреждающих ткани мозга перекисных процессов, в предотвращении которых важное значение имеет высокая и стабильная антиоксидантная активность восстановленной формы pQQ. Еще один механизм развития этого заболевания обусловлен образованием 6-гидроксидофамина, который повреждает нейроны. рQQ предотвращает и такое повреждение, но не только за счет антиоксидантного эффекта. pQQ подавляет образование амилоидных фибрилл и их агрегацию. Кроме того, pQQ образует конъюгаты с a-Syn, и эти конъюгаты также предотвращают образование фибрилл. pQQ снижает их цитотоксичность, в силу чего представляет интерес как потенциальный ингибитор рассматриваемых процессов. Дефицит pQQ служит причиной дефектов в иммунной системе, тормозя проявление Т-клеточного звена иммунитета. Немаловажное значение здесь имеет способность pQQ активировать митохондриогенез, поскольку, как показано в последнее время, митохондрии являются не только продуцентами АТФ, но и важными регуляторами иммунитета. Иммунотропное действие pQQ обусловливает его противовоспалительный эффект, значительно более выраженный, чем у a-токоферола, что является важным фактором в профилактике нейродегенеративных нарушений.
Одним из механизмов нейротропной активности pQQ является защитное действие на NMDA-рецепторы мозга. Редокс-активные соединения модулируют функцию NMDA-рецепторов так, что восстановление рецепторного редокс-сайта повышает, а окисление понижает активность, влияя таким образом на эпилептоформный эффект. Редокс-модулирующим действием рQQ на N-метил-Dаспартатные рецепторы (NMDA-рецепторы) мозга обусловлено его антиэпилептическое и антисудорожное действие. Динамическая регуляция NMDA-рецепторной функции редокс-окружением, в том числе pQQ как эффективным редокс-циклическим фактором, может быть критическим механизмом в подавлении эпилептогенной активности и мишенью для терапевтического воздействия.
• pQQ при шизофрении
• pQQ в комбинации с клозепином через NMDA-рецептор может улучшать и нормализовывать поведенческие реакции, локомоторную гиперактивность и когнитивные нарушения при экспериментальной шизофрении. Было установлено, что модулирующее действие этой комбинации на NMDAрецептор 1 может нормализовать нарушения памяти путем понижения экспрессии этого рецептора, изменения процессов гиперфосфорилирования в гипокампе и ингибирования апоптоза через соответствующие сигнальные пути.
• pQQ при ишемии мозга
• pQQ эффективно уменьшает область инфарктного повреждения при церебральной гипоксии/ишемии и в дозах 10–15 мг/кг веса способствует уменьшению области церебрального инфаркта у крыс даже через 72 часа и более после инсульта. Эти и другие данные свидетельствуют о том, что pQQ может быть эффективным протектором при подобных нарушениях мозгового кровообращения. Более того, pQQ при профилактическом применении предотвращает повреждения головного мозга при травмах. Таким образом, pQQ может использоваться как перспективный продукт в профилактике нейродегенеративных заболеваний [19].
• pQQ при диабете и диабетической нефропатии
• pQQ подавляет оксидативный стресс и перекисное окисление липидов в мозгу мышей с стрептозотоцин-индуцированным диабетом, подавляет окислительный стресс у крыс с диабетической нефропатией: ослабляет стрессорную реакцию, активирует сигнальные пути восстановления митохондриогенеза и, как результат, улучшает сниженные ренальные функции, предотвращает структурные нарушения, обусловленные повышенным оксидативным стрессом, в том числе связанным с повышенным уровнем глюкозы в крови [12–17].
ЗАКЛЮЧЕНИЕ
Пирролохинолинхинон pQQ представляет собой уникальный микронутриент, обладающий в силу специфики своей структуры рядом уникальных свойств, среди которых необходимо выделить: а) высокую антиоксидантную и антирадикальную активность его восстановленной формы; б) способность к многократной регенерируемости его активной формы, значительно превосходящей этот показатель у других природных антиоксидантов; в) активность в нейтрализации высокотоксичного оксиданта пероксинитрита — фактора оксидативного и нитросативного стрессов, в том числе важного в нейропатологии и кардиологии синдрома Такоцубо; г) уникально высокая активность в стимулировании митохондриогенеза, значительно превосходящая таковую в случае всех изученных природных веществ такого действия. Указанные свойства предопределяют потенциальную значимость pQQ в профилактике и терапии широкого круга заболеваний цивилизации, относящихся к митохондриальной патологии.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
Поступила в редакцию 11.09.2022.
Принята в печать 09.10.2022.
CONFLICT OF INTEREST
The authors declares that there is no conflict of interest.
Received 11.09.2022.
Accepted for publication 09.10.2022.


