Введение
Проблема лечения и реабилитации больных с эпителиальным копчиковым ходом (ЭКХ) остается актуальной до настоящего времени. С одной стороны, это связано с частотой развития заболевания. Пациенты с воспалениями ЭКХ в среднем составляют 1–2 % от всех хирургических больных, причем в общей популяции заболевание встречается у 26 на 100 000 человек населения [1, 2]. С другой стороны, данное заболевание проявляется в активном трудоспособном возрасте, наиболее часто страдают лица мужского пола в возрасте до 30 лет.
Несмотря на многолетнее изучение вопросов лечения и реабилитации данной категории больных и наличие множества вариантов оперативных вмешательств [3–9], до сих пор сохраняются длительные сроки заживления ран крестцово-копчиковой области, которые составляют от 14 до 80 суток, а количество послеоперационных раневых осложнений остается высоким и достигает 50 % [10]. Одной из причин этого является отсутствие единой общепринятой тактики назначения антибактериальных препаратов у данной категории больных. В доступной научной литературе этому вопросу практически не уделяется должного внимания [11, 12, 13, 14, 15].
Таким образом, вопросы антибиотикопрофилактики и лечения больных с воспалениями ЭКХ остаются весьма актуальными. С учетом изложенного задачами исследования являлись:
• изучение микробного пейзажа возбудителей воспалений ЭКХ;
• оценка чувствительности выделенных микроорганизмов к антибактериальным средствам;
• подбор наиболее рациональных схем эмпирической антимикробной терапии на основе полученных данных.
Материалы и методы
Были проанализированы результаты микробиологического исследования проб 146 больных с воспалениями эпителиальных копчиковых ходов, находившихся на лечении в университетской клинике общей хирургии и колопроктологии РНИМУ имени Н. И. Пирогова на базе ГБУЗ ГКБ № 24 в 2014–2017 годах.
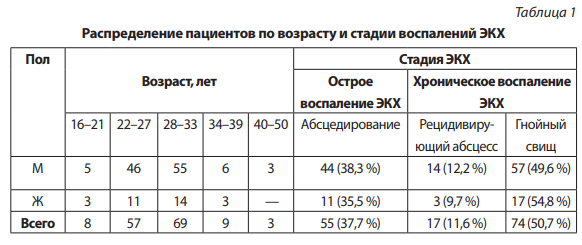
Все 146 больных перенесли оперативное пособие в крестцово-копчиковой области и находились на лечении с диагнозом «Острое или хроническое воспаление ЭКХ». Распределение пациентов по возрасту, полу и стадии процесса представлено в таблице 1. В исследованной группе преобладали лица мужского пола. Соотношение мужчин и женщин составило примерно 4:1. Средний возраст пациентов — 29 ± 6,4 лет. В 72 случаях (49,3 %) пациентам было произведено вскрытие абсцесса в крестцово-копчиковой области. У остальных 74 (50,6 %) больных произведены радикальные иссечения основного источника хронического воспаления вместе с вторичными гнойными свищами. У всех больных ведение ран в послеоперационном периоде осуществлялось открытым способом.
Микробиологические исследования раневого биоматериала проводили в соответствии с требованиями приказа МЗ РФ № 535 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений» [16].
Из исследования было исключено 12 пациентов, у которых не удалось выделить культуры возбудителей инфекции, что, возможно, связано с облигатно-анаэробной природой микроорганизмов либо с самостоятельным несанкционированным применением антимикробных средств до момента взятия биологического материала на бактериологическое исследование.
Идентификацию выделенных микроорганизмов и определение чувствительности к антимикробным препаратам проводили с помощью тест-систем анализаторов autoSCAN фирмы BECMAN COULTER и SENSITITRE ARIS фирмы TREK Diagnostic. Материалом для идентификации служили изолированные колонии на чашке или чистые культуры в пробирках, из которых готовили микробную суспензию в концентрации 0,5 оптические единицы по Мак Фарланду (стандарт оптической плотности). Инокулюм вносили в лунки с субстратами данных тест-систем и в лунки, содержащие антимикробные препараты в определенных концентрациях (break point). Планшеты инкубировали при температуре 36 °С в течение 24 часов. Учет осуществляли автоматически, используя аналитический блок анализаторов с последующей компьютерной обработкой данных. Гемолитическую, плазмокоагулазную, лецитиназную, фибринолитическую активность возбудителей выявляли по общепринятым методикам [17, 18].
Данные о чувствительности интерпретировали в соответствии с российскими клиническими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам», версия-2015–02, и международным стандартом EUCAST, версия 8.0, 2018 [19].
Результаты и обсуждение
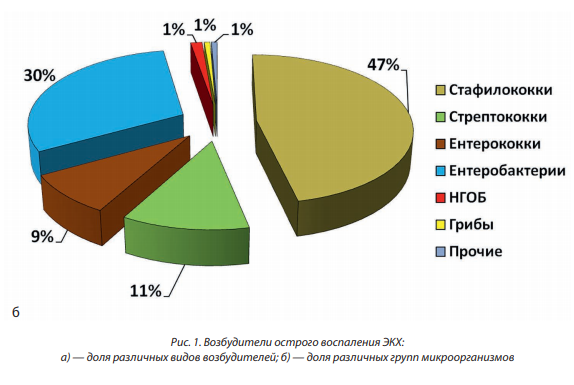
При бактериологическом исследовании раневого биоматериала пациентов с острыми воспалениями ЭКХ наиболее часто высевалась грамположительная микрофлора. Результаты показали явное превалирование грампозитивной микрофлоры (рис. 1). На долю грамположительных культур стафилококков, стрептококков, энтерококков приходилось в сумме 66,9 % выделенных микробных культур. Грамнегативные культуры — энтеробактерии и неферментирующие грамотрицательные бактерии (НГОБ), были выделены в 31,8 % случаев. На долю прочих возбудителей приходилось 1,35 % от всех исследований.
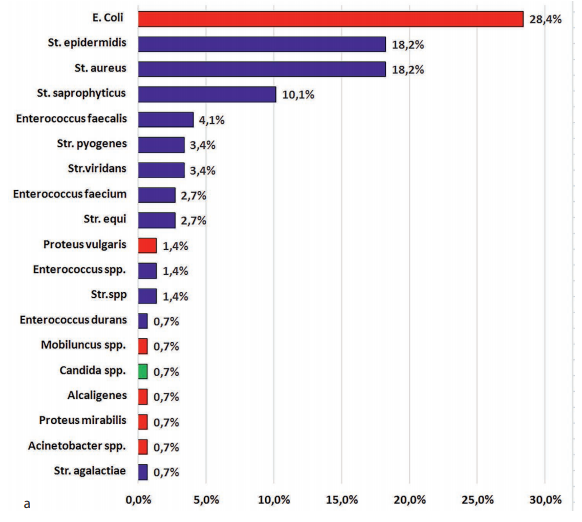
Микробные ассоциации определялись у 10 пациентов (7 % случаев). У остальных 127 (93 %) больных флора была представлена в монокультуре. Во встретившихся ассоциациях микроорганизмов St. aureus сочетался с Enterococcus faecalis и в 2 случаях с E. сoli; St. epidermidis — с Enterococcus faecalis и с E. coli. Наиболее часто в ассоциациях встречалась E. сoli (8 случаев из 10–80 %): в 2 случаях в сочетании с St. aureus, в 2 случаях — с St. epidermidis, по 1 случаю — в сочетании с Corynebacterium spp, Enterococcus durans, Str. equi, Enterococcus faecium.
Следует отметить, что в то время как у пациентов, обратившихся по поводу острого воспаления ЭКХ, высевалась преимущественно грамположительная флора, у пациентов с хроническим воспалением ЭКХ чаще высевалась грамотрицательная флора.
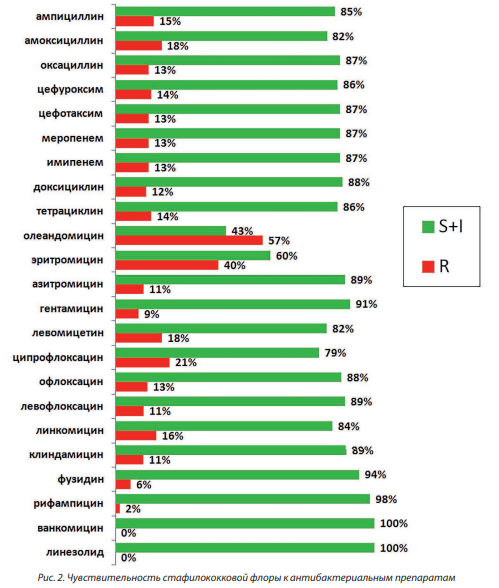
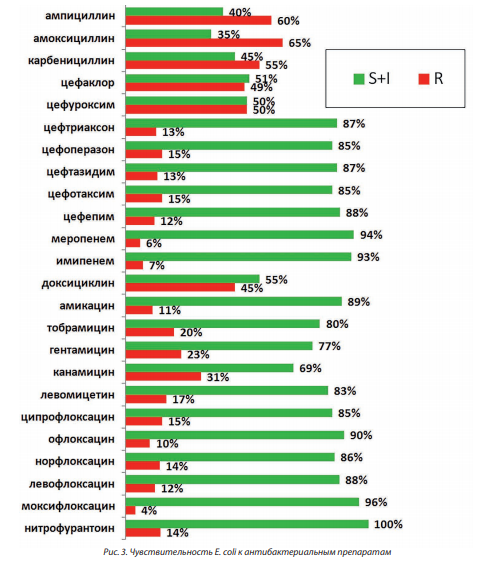
При изучении резистентности основных возбудителей воспалений ЭКХ было обнаружено, что стафилококковая микрофлора обладала относительно высокой устойчивостью к макролидам и проявляла высокую чувствительность к большинству исследованных препаратов (рис. 2). Из приведенных данных следует, что наиболее эффективными антистафилококковыми препаратами при этой патологии являются оксазолидиноны (Линезолид), гликопептиды (Ванкомицин) и ансамицины (Рифампицин). Макролиды, фторхинолоны и хлорамфеникол были наименее эффективными против стафилококков in vitro. В то же время E. coli демонстрировала резистентность (≥ 30 %) к группе пенициллинов, включая ингибиторзащищенные формы, к цефалоспоринам первой и второй генерации, аминогликозидам и тетрациклинам (рис. 3). Таким образом, их использование в эмпирической терапии воспалений ЭКХ можно считать нецелесообразным. Стрептококки проявляли наиболее высокую чувствительность к большинству из исследованных групп препаратов, за исключением макролидов и фторхинолонов.

В группе пациентов хроническим воспалением ЭКХ зачастую выделялись бактериальные штаммы с множественной и экстремальной резистентностью к антибактериальным препаратам: E. сoli, продуцирующая бета-лактамазы расширенного спектра (БЛРС), обеспечивающие резистентность к антибиотикам бета-лактамной группы (пенициллинам, цефалоспоринам 1–4 генераций). Такие штаммы в 70 % случаев имели ассоциированную резистентность к фторхинолонам и аминогликозидам. В одном случае выделена E. сoli с фенотипом продуцента карбапенемаз, обеспечивающим ее резистентность к ингибитор-защищенным пенициллинам и цефалоспоринам и к карбапенемам (имипенему, меропенему, дорипенему, эртапенему).
Среди популяции изолированных стафилококков зафиксировано 8 штаммов (14 %) МРСА и МРС когулазонегативных стафилококков, что гарантировало неуспех клинического применения любых бета-лактамных антибиотиков, начиная с пенициллинов и кончая карбапенемами. Такие штаммы также зачастую имеют ассоциированную резистентность к фторхинолонам, аминогликозидам, макролидам и тетрациклинам.
Заключение
Таким образом, при остром воспалении ЭКХ в качестве эмпирической стартовой терапии необходимо использовать фторхинолоны, цефалоспорины 3 и 4 поколения, аминогликозиды, тетрациклины. Комбинированная терапия данными группами препаратов позволит добиться более гарантированного эффекта лечения и профилактики рецидива инфекции. При хроническом воспалении ЭКХ целесообразно применение стартовой комбинированной терапии антибиотиками группы резерва: Ванкомицин или Линезолид в сочетании с карбапенемами и ингибитор-защищенными пенициллинами или цефалоспоринами.
Следует подчеркнуть, что консервативная терапия воспалений ЭКХ никоим образом не исключает необходимость хирургического вмешательства. Основным методом лечения острого и хронического воспаления ЭКХ остается оперативное вмешательство, направленное на ликвидацию гнойного очага. В то же время в комплексном лечении данной категории больных должна быть использована рациональная антибактериальная терапия.


