Причины кровотечения из верхних отделов желудочно-кишечного тракта (ЖКТ) у больных с ЦП могут быть разделены на две группы. Первая группа включает повреждения, ассоциированные с портальной гипертензией (ПГ), а именно гастроэзофагеальным варикозом и портальной гипертензивной гастропатией. Вторая группа включает поражения, не связанные с ЦБ и ПГ (язвенная болезнь желудка и двенадцатиперстной кишки, эрозивный гастрит, реф люкс-эзофагит, синдром Маллори — Вейсса, опухоли и т. д.) [8].
Варикозно расширенные вены (ВРВ) пищевода обнаруживаются у 30–40 % пациентов с компенсированным ЦП и в 60 % — с декомпенсированным ЦП на момент его диагностики [2, 8]. Частота кровотечений из ВРВ пищевода у больных ЦП составляет в среднем 4 % в год. Риск увеличивается до 15 % у пациентов с венами средних и больших размеров [15]. Риск развития повторного кровотечения очень высок и зависит от тяжести ЦБ: в первый год рецидив кровотечения наблюдается у 28 % пациентов с функциональным классом А (по Child — Pugh), в 48 — с классом B, в 68 % — с классом C [4].
Несмотря на достижения последних десятилетий, кровотечения из ВРВ пищевода и желудка сопровождаются смертностью в 10–20 % в течение шести недель [3].
После остановки острого кровотечения, если не осуществлять необходимые действия, у 60 % этих пациентов будет повторное кровотечение со смертностью около 33 % [2, 8].
Основными причинами пищеводно-желудочных кровотечений при ПГ являются [2]:
• резкое повышение давления в портальной системе (повышение порто-системного градиента более 12 мм рт. ст.);
• нарушения свертываемости крови;
• трофические изменения слизистой оболочки пищевода и желудка вследствие нарушения циркуляции крови и влияния кислотно-пептического фактора.
Всегда организация и проведение диагностических и лечебных процедур у пациентов с ЦП и кровотечением из верхних отделов ЖКТ являются сложным процессом, и во многих случаях его реализация вызывает значительные трудности.
Осознание этих проблем привело к организации ряда встреч на основе консенсуса. Первая из них была организована Э. Burroughs в Гронингене (Нидерланды) в 1986 г. [10]. После Гронингена другие встречи проходили в Бавено (Италия). Так, в 1990 г. созданы рекомендации Baveno I. Целью и задачами этих встреч была разработка определения ключевых положений в определении ПГ и варикозного кровотечения, просмотр имеющихся данных о патогенезе, диагностике и методах лечения ПГ, а также предложение рекомендаций по проведению клинических исследований и лечения больных, основанных на данных доказательной медицины. Последний семинар Baveno VI был проведен 10–11 апреля 2015 г. в городе Бавено. Уровень имеющихся доказательств оценивали традиционно, и рекомендации были ранжированы в соответствии с Оксфордской системой [5] (т. е. уровень доказательности от 1 (высокий) до 5 (низкий), степень рекомендации от А (сильный) до D (слабый).
Прогностические критерии возникновения кровотечения из ВРВ пищевода и желудка [2, 4]:
• III степень ВРВ;
• локализация ВРВ;
• степень дилатации пищевода;
• напряжение ВРВ — падение вен при инсуффляции воздухом;
• тяжесть васкулопатии для вен пищевода и тяжесть гастропатии для ВРВ желудка;
• портокавальный градиент > 12 мм рт. ст.;
• тяжесть функционального состояния печени (ЦП класса С по Чайлд);
• тромбоз воротной вены у больных ЦП.
Во время госпитализации пациента с острым кровотечением одним из важнейших шагов является выявление у него ЦП. Надо проводить анализ анамнестических (в том числе с помощью родственников больного), клинических данных и результатов лабораторных исследований (тромбоцитопения, изменения коагулограммы, печеночные пробы) [11].
При проведении верхней эндоскопии (насколько возможно быстро) прежде всего нужно непосредственно диагностировать наличие кровотечения, его источник, определиться с наличием и локализацией ВРВ и установить степень выраженности их расширения.
По локализации выделяют кровотечение из пищевода (ограниченный варикоз средней и нижней трети пищевода или тотальный варикоз) и кровотечение из желудка.
При варикозном расширении ВРВ желудка выделяют четыре типа вен: I тип — гастроэзофагеальные ВРВ с распространением на кардиальный и субкардиальный отделы малой кривизны желудка; II тип — гастроэзофагеальные ВРВ от эзофагокардиального перехода по большой кривизне в направлении ко дну желудка; III тип — изолированные ВРВ же лудка без ВРВ пищевода — варикозная трансформация вен фундального отдела желудка; IV тип — эктопические узлы тела, антрального отдела желудка, двенадцатиперстной кишки (рис. 1) [2].
Наиболее широкое применение получила классификация варикозных вен по степени выраженности [2]:
I степень — диаметр вен 2–3 мм;
II степень — диаметр вен 3–5 мм;
III степень — диаметр вен > 5 мм.
После установления диагноза лечебные мероприятия должны проводиться как можно быстрее.
Основные задачи лечения:
• остановка кровотечения;
• компенсация кровопотери;
• лечение коагулопатии;
• предотвращения рецидивов кровотечения;
• предотвращение ухудшения
функции печени и осложнений, обусловленных кровотечениями (инфекции, печеночная энцефалопатия и т. д.) [1].
Необходимо проводить защиту дыхательных путей, но нет достаточно доказательств, чтобы рекомендовать профилактическую интубацию трахеи [24, 27]. Считается, что интубация трахеи должна быть выполнена до эндоскопии у больных с постоянной рвотой, гемодинамической нестабильностью, ажитацией с отсутствием сотрудничества с врачом во время исследования или показателем по шкале комы Глазго менее 8 [12].
Часто является необходимой трансфузия эритромассы для поддержки показателя гемоглобина (Hb) на уровне 80 г/л (Ib; A). Переливание крови связано с уменьшением дальнейшего кровотечения и возникновением повторного кровотечения, снижением частоты осложнений, а также с увеличением выживаемости [13]. Эти положения представлены в рекомендациях консенсуса Baveno V. и [10].
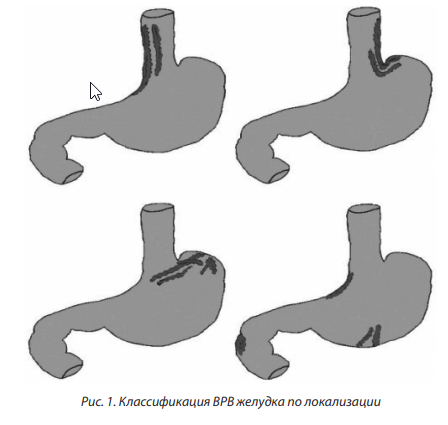
Эзофагогастродуоденоскопия (ЭГДС) проводится сразу же при поступлении больного в стационар.
При отсутствии противопоказаний (QT пролонгации) по 30–120 мин до проведения эндоскопии рекомендуется введение внутривенно 250 мг Эритромицина (1b, А).
Восполнение ОЦК путем осторожного введения свежемороженой плазмы (СМП) (1B; A).
Трансфузия эритроцитарной массы для поддержания содержания гемоглобина на уровне 80 г/л (Ib; A).
Антибиотикопрофилактика спонтанного бактериального перитонита (Ia; A).
Профилактика печеночной энцефалопатии (V; D).
Баллонная тампонада используется только при массивном кровотечении как временная мера (IIb; B).
При подозрении на кровотечение из ВРВ надо как можно раньше назначать вазоактивные препараты (1a; A), используя их в сочетании с эндоскопической терапией длительно, в течение пяти дней (1а, А).
Следует контролировать уровень натрия, поскольку описаны случаи гипонатриемии при приеме Терлипрессина, особенно у пациентов с сохраненной функцией печени (1b, А).
Эндоскопическое лигирование является рекомендуемым методом гемостаза при кровотечении из ВРВ пищевода, в случае невозможности его выполнения можно использовать эндоскопическую склеротерапию (ЭС) (1b; A).
При кровотечении из ВРВ желудка используется тканевый адгезив (N-butyl-cyanoacrylate) (5; D).
В соответствии с механизмом снижения портального давления все лекарственные средства можно разделить на две основные группы.
1. Венозные вазодилататоры:
• нитраты (нитроглицерин или изосорбид-5-мононитрат) — периферический вазодилататор, снижает печеночный венозный градиент на 40–44 %; нитропруссид натрия.
В качестве монотерапии нитраты используются редко, обычно их комбинируют с Вазопрессином и его аналогами.
Нитроглицерин 1 % — 1,0 мл на 400 мл раствора Рингера или изотонического раствора хлорида натрия вводят внутривенно капельно (10–12 капель в минуту). Включение нитратов в схему лечения возможно лишь при стабильной гемодинамике (уровень систолического артериального давления более 100 мм рт. ст.) и после коррекции гиповолемии [1].
2. Вазоконстрикторы:
• Соматостатин (Сандостатин, Октреотид) — селективная вазоконстрикция внутренних органов, связанная с подавлением активности эндогенных вазодилататоров (в частности, Глюкагон) и секреции соляной кислоты. Портальное давление снижается на 20–25 %. Октреотид вводят сначала болюсно в дозе 50–100 мкг, затем переходят на длительную инфузию в дозе 25–50 мкг/ч в течение 5–7 дней;
Вазопрессин, Вапреотид, Терлипрессин — уменьшают артериальный приток в портальную систему, снижая портальное давление на 30–40 %.
Кокрановский обзор включил 21 исследование с участием 2588 больных с активным варикозным кровотечением и не выявил отличия в смертности или риска рецидива кровотечения при лечении Соматостатином и его производными (например, Октреотидом) [17]. Недавнее сравнительное исследование применения Терлипрессина, Соматостатина и Октреотида для контроля острого пищеводного варикозного кровотечения не показало никакой разницы в гемостатической эффективности между этими препаратами [28]. Кроме того, это же исследование показало, что уровень смертности существенно не отличается в группах пациентов, принимавших эти три препарата в условиях комбинированной терапии с эндоскопическим лечением. Поэтому любой из этих препаратов может быть использован в сочетании с эндоскопической терапией для контроля кровотечения из вен пищевода.
ПРИМЕНЕНИЕ ЗОНДАОБТУРАТОРА СЕНГСТАКЕНА — БЛЭКМОРА
После установления диагноза «кровотечение из ВРВ пищевода или желудка» и изъятия эндоскопа часто используют зонд-обтуратор Сенгстакена — Блэкмора, чем достигается временный надежный гемостаз (рис. 2).
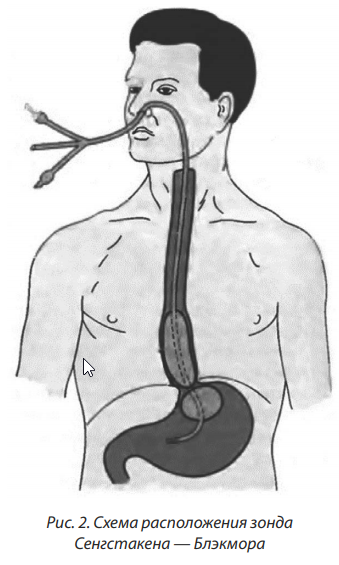
Зонд-обтуратор вводят через носовой ход, заводя желудочный баллон глубоко в желудок, предварительно замерив расстояние от мочки уха до надчеревья, что служит ориентиром правильного расположения зонда-обтуратора в пищеводе и желудке. Затем, с помощью градуированного шприца, присоединенного к катетеру желудочного баллона, в последний вводят воздух в количестве 150 см3 , катетер перекрывают зажимом. Зонд подтягивают до ощущения упругого сопротивления, чем и достигают сдавления вен в зоне кардии. После этого зонд фиксируют. Пищеводный баллон раздувают редко, и только тогда, когда идет отрыжка кровью, в противном случае достаточно раздувание только желудочного баллона. После того как зонд установлен, аспирируют желудочное содержимое и промывают желудок холодной водой.
Контроль за кровотечением осуществляется путем динамического наблюдения за желудочным содержимым, поступает по зонду после тщательного промывания желудка. Чтобы избежать пролежней на слизистой оболочке пищевода, пищеводный баллон распускают каждые 4 ч, и если в этот момент в желудочном содержимом примеси крови не появляются, то пищеводного манжету оставляют спущенной. Желудочную манжету распускают позже — через 1,5–2 ч. У больных с удовлетворительной функцией печени зонд должен находиться в желудке еще в течение 12 ч для контроля за желудочным содержимым, а затем его удаляют. После удаления зонда-обтуратора необходимо сразу рассмотреть вопрос о выполнении одного из вариантов эндоскопического гемостаза. В случае рецидива кровотечения зонд-обтуратор должен быть введен снова, баллоны должны быть раздуты, а больному ЦБ (группа А и В) должна быть предложена операция или эндоскопический гемостаз, потому возможности консервативной терапии следует считать исчерпанными [10].
Зонд устанавливается для того, чтобы контролировать кровотечение и в то время, когда медперсонал готовится к проведению эндоскопического или хирургического лечения [13]. Баллонная тампонада эффективна при кровотечениях, она обеспечивает эффективный контроль примерно у 80 % пациентов, но рецидив кровотечения происходит примерно в 50 % случаев после окончания процедуры.
Эндоскопическое лечение
Для обеспечения эндоскопического гемостаза при кровотечении из ВРВ пищевода и желудка используют следующие методы:
• лигирование;
• склеротерапию;
• клеевые композиции;
• стентирование пищевода.
Для выполнения эндоскопического лигирования (ЭЛ) ВРВ пищевода используется устройство с набором из 6–10 латексных колец [15].
Помимо лечения острого кровотечения из ВРВ пищевода показаниями к ЭЛ являются:
• профилактика первого эпизода кровотечения (первичная профилактика);
• профилактика рецидива кровотечения (вторичная профилактика) из ВРВ пищевода у больных с ПГ при невозможности хирургического лечения;
• при наличии ВРВ пищевода у ранее оперированных больных или после эндоскопического склерозирования вен кардиального отдела желудка.
Надо знать об ограничении этой методики, а именно о невозможности лигирования вен в фундальном отдела желудка, об опасности ЭЛ при профузном кровотечении, о трудности выполнения ЭЛ после эндоскопического склерозирования ВРВ, невозможности ЭЛ вен малого диаметра.
Существует дифференцированный подход к лигированию ВРВ пищевода и желудка.
Эндоскопическое склерозирование (ЭС) вен пищевода — это метод, предложенный в 1939 г. C. Crafoord и P. Frenckner. Облитерация варикозных вен происходит после введения в просвет вены склерозана через эндоскоп с помощью длинной иглы. Наряду с интравазальным способом склеротерапии существует метод паравазального введения склерозанта, который основан на введении склерозана рядом с веной, в результате чего происходит сдавление варикозных узлов — сначала за счет отека, а затем за счет образования соединительной ткани.
Для интравазального введения чаще всего используют тетрадецилсульфат натрия (Тромбовар).
В случаях, когда с помощью склеротерапии не удается остановить кровотечение (при ВРВ желудка), применяют цианокрилатные клеевые композиции. Используют два тканевых клея: N-бутил-2-цианокрилат (Гистоакрил) и изобутил-2цианокрилат (Букрилат). При попадании в кровь цианокрилат быстро полимеризуется (20 с), вызывая облитерацию сосуда, чем достигается гемостаз. Через несколько недель после инъекции клеевая пробка отторгается в просвет желудка.
Время проведения инъекции ограничено 20 с через полимеризацию Гистоакрила, что не позволяет широко применять этот метод для лечения и профилактики кровотечений из ВРВ пищевода и желудка [13].
При неэффективности эндоскопического гемостаза и наличии источника кровотечения в пищеводе возможно использование стента Даниша (Danis) [10].
Эндоваскулярные методы лечения кровотечений из ВРВ пищевода и желудка включают:
• транспеченочную подкожную облитерацию внеорганных вен желудка;
• трансъюгулярное внутрипеченочное портосистемное шунтирование (TIPS).
Эндоваскулярная эмболизация ВРВ желудка применяется с целью профилактики и лечения кровотечения из ВРВ эзофагокардиальной зоны. Но она также эффективна и при рецидивах кровотечений из вен желудка. Осуществить эту манипуляцию возможно только в клиниках, имеющих рентгеноангиографическую аппаратуру. Через шесть месяцев после первой процедуры необходимо повторять процедуру в связи с быстрой реканализацией тромбированных вен и высоким риском рецидива кровотечения. Эта методика может быть реализована только у больных ЦП и проходной воротной веной. Фатальным осложнением такой методики является тромбоз воротной вены с неконтролируемым кровотечением из ВРВ пищевода и желудка.
Большой интерес клиницистов вызвало внедрение во врачебную практику TIPS (transjugular intrahepatic portosystemic shunt), разработанного J. Rosch и соавторами в 1969 г. [14].
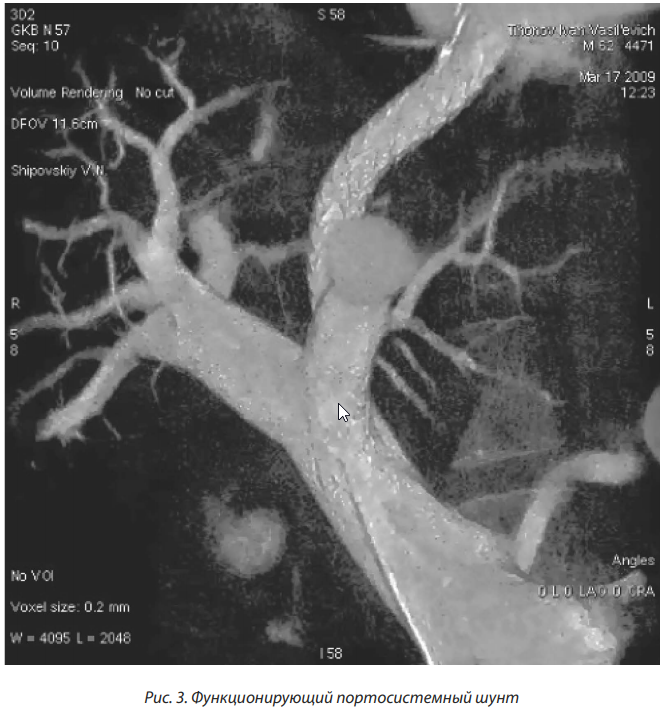
TIPS является малоинвазивной хирургической операцией, проводимой под контролем рентгеноскопии и включает в себя ряд эндоваскулярных процедур в определенной последовательности: после пункции яремной вены с помощью сосудистых стентов (голометалических или стент-графтов) формируется внутрипеченочное сообщение между крупными печеночными венами и ветвями воротной вены. Вследствие использования TIPS сохраняется гепатопетальний кровоток и осуществляется портальная декомпрессия (рис. 3).
Показания к TIPS [19]:
1. Кровотечение из ВРВ пищевода и желудка продолжается и не останавливается с помощью медикаментозной терапии или эндоскопических методов.
2. Повторные кровотечения у пациентов, прошедших эндоскопическое лечение с/без терапией ß-блокаторами и/или имеющих противопоказания к эндоскопическому вмешательству. Рецидивом следует считать повторное появление мелены и/или рвота с кровью даже при наличии стабильных гемодинамических показателей и уровня гемоглобина и гематокрита в течение по крайней мере 24 ч после первого эпизода острого кровотечения.
3. Резистентный к диуретической терапии асцит.
4. Печеночный гидроторакс, резистентный к диуретической терапии и/ или его рецидив после плевральных пункций.
Противопоказаниями к проведению TIPS являются:
1. Показатель MELD > 20 баллов или при проведении TIPS по поводу резистентного к диуретической терапии асцита.
2. Количество баллов по шкале Child — Turcotte — Pugh > 11 или общий билирубин более 60 мкмоль/л при проведении TIPS по поводу кровотечений из ВРВ.
3. Печеночная энцефалопатия 3–4-й степени, не поддающаяся медикаментозному лечению.
4. Ишемическая болезнь сердца или дилатационная кардиомиопатия, ассоциированные с недостаточностью кровообращения выше I степени.
5. Повреждения, опухоли печени, поликистозная болезнь печени, агональное состояние.
При функциональном классе ЦБ А и В проведение хирургического вмешательства считается возможным, при декомпенсированном ЦП (класс С) риск операции предельно высок, и при возникновении кровотечений из ВРВ пищевода и желудка предпочтение следует отдавать консервативным или малоинвазивным методам лечения.
Комбинированная терапия (вазоактивные препараты и эндоскопическая терапия) является более эффективной, чем монотерапия, что было показано в нескольких рандомизированных контролируемых исследованиях и метаанализах [8, 16, 29].
ПОДХОДЫ К КУРАЦИИ РАЗЛИЧНЫХ ВАРИАНТОВ НЕВАРИКОЗНОЙ ПОРТАЛЬНОЙ ГАСТРОПАТИИ
Неварикозные изменения в желудке у больных с ПГ включают портальную гипертоническую гастропатию, или portal hypertensive gastropathy (PHG), и желудочную антральную сосудистую эктазию, или gastric antral vascular ectasia (GAVE). Эти два варианта четко разделены портальной гастропатией с различными патофизиологией, эндоскопической картиной и лечением [8].
Для PHG характерна мозаичность слизистой оболочки желудка с красными пятнами или без них, которые видны довольно часто у пациентов с ЦП. Эти изменения обычно наблюдаются в дне и теле желудка. К гистопатологическим особенностям PHG относят сосудистую эктазию слизистой оболочки и подслизистых вен и капилляров [7]. PHG считается мягкой, когда имеются только мозаичные изменения, и тяжелой — когда есть красные пятна или диффузные геморрагические поражения [7]. Между тем кровотечение, связанное с PHG, может быть острым или хроническим. Хроническое кровотечение часто приводит к железодефицитной анемии и случается гораздо чаще, чем острое кровотечение [23]. Подходы к лечению выраженной PHG включают неселективные ß-адреноблокаторы, эндоскопическое лечение и каутеризацию [32]. Неселективные ß-адреноблокаторы уменьшают риск возникновения кровотечений у пациентов с ЦБ, имеют PHG, однако фармакологическая терапия на сегодняшний день не рекомендуется для первичной профилактики кровотечения у больных с тяжелой PHG [7]. Небольшие исследования показали, что вазоактивные лекарственные препараты, такие как Октреотид и Терлипрессин, могут быть полезны для лечения острого кровотечения [32]. ß-блокаторы рекомендуются для профилактики хронической кровопотери у пациентов, имевших кровотечение при тяжелой PHG [22]. Эндоскопическая терапия в виде каутеризации или склеротерапии может быть эффективной у пациентов, имеющих острые кровотечения, вызванные PHG, и может быть использована для прекращения хронического кровотечения, вызванного PHG. TIPS следует рассматривать как спасительную терапию у пациентов с рецидивом кровотечения, несмотря на фармакологическую и эндоскопическую терапию [20].
У пациентов с GAVE скопления эктазированных сосудов можно увидеть при эндоскопическом обследовании в виде красных пятен без мозаичного фона. Как видно из аббревиатуры GAVE, как правило, эти изменения находятся в антральном отделе желудка. GAVE также может наблюдаться у больных без ЦБ и ПГ. Лечение больных с кровотечением, связанным с GAVE, существенно отличается от лечения кровотечения при PHG, поскольку она не отвечает на терапию, направленную на лечение ПГ. Основой терапии GAVE является эндоскопическая абляция поражений [18]. Существуют различные эндоскопические методы лечения GAVE, в том числе аргон-плазменная коагуляция, криотерапия и лазерная терапия [25].
Аргон-плазменная коагуляция достаточно проста в исполнении методики со значительно меньшим, чем при лазерной терапии, риском перфорации [26]. Сеансы должны повторяться каждые 2–6 недель, в зависимости от необходимости. Когда эндоскопическая терапия потерпит неудачу, проводят хирургическое вмешательство (с антрумэктомией). В отличие от PHG, TIPS не умаляет риска кровотечений у пациентов с GAVE, и ее проведение связано с повышенным риском печеночной энцефалопатии [20]. Итак, TIPS не рекомендуется при GAVE.
АНТИБИОТИКОПРОФИЛАКТИКА
Общеизвестно, что больные ЦБ с желудочно-кишечным кровотечением имеют высокий риск развития бактериальных инфекций, которые обусловливают высокую смертность [21]. Однако вероятность повторного кровотечения и смертность снижаются, когда пациенты получают профилактическое назначение антибиотиков, которые на сегодня являются частью стандарта лечения этих больных [30]. Рекомендуемый антибиотик Норфлоксацин в дозе 400 мг перорально дважды в день [25] или Ципрофлоксацин 200 мг два раза в день, если пероральный путь не представляется возможным. У больных с ЦП класса B или C Цефтриаксон оказался более эффективным, чем пероральный Норфлоксацин [9].
МЕДИКАМЕНТОЗНАЯ (ВТОРИЧНАЯ) ПРОФИЛАКТИКА РЕЦИДИВА КРОВОТЕЧЕНИЯ
Медикаментозная (вторичная) профилактика рецидива кровотечения должна начинаться как можно скорее, поскольку первый эпизод желудочно-кишечного кровотечения у больных ЦП в 60 % случаев сопровождается ее рецидивом [2, 10].
С этой целью назначаются неселективные ß-адреноблокаторы (Пропранолол, Надолол), которые позволяют снизить риск рецидива кровотечения на 30–40 %. Препараты назначаются в дозе, которая уменьшает частоту пульса в покое на 25 %, или при исходно низком пульсе (до 55 ударов в минуту).
В указанной группе пациентов возможно применение Карведилола, который является неселективным блокатором ß- и α-адренорецепторов. В клинических исследованиях было показано, что назначение Карведилола у больных ЦП вызывает более выраженное уменьшение портального давления.
ПРОФИЛАКТИКА ПЕЧЕНОЧНОЙ ЭНЦЕФАЛОПАТИИ
Последние исследования показывают, что Лактулоза и Рифаксимин могут предотвратить печеночную энцефалопатию у больных ЦП при верхнем желудочно-кишечном кровотечении (1b, А) [10].
Итак, оптимальная курация острого верхнего кровотечения при ЦБ требует очень тщательного подхода, в частности: своевременной адекватной оценки состояния больного и проведения реанимационных мероприятий; переливания препаратов крови; использования вазоактивных препаратов; эффективной ранней диагностической и лечебной эндоскопии (менее чем через 12 ч после поступления в стационар); введения антибиотиков с профилактической целью; а также (по возможности) проведения TIPS или хирургического вмешательства в случае неэффективности эндоскопического и малоинвазивного лечения.
В завершение следует отметить, что решение клинической проблемы желудочно-кишечного кровотечения у пациента с ЦП требует слаженных действий специалистов различных специальностей: реаниматологов, гастроэнтерологов, эндоскопистов и хирургов. Постоянное совершенствование профессиональных знаний и практических умений врачей даст возможность достигать хороших клинических результатов при лечении таких пациентов.


