ОБЩИЕ СВЕДЕНИЯ
Аденомы гипофиза (АГ) составляют примерно 10 % всех внутричерепных новообразований. Несмотря на то, что эти опухоли чаще всего являются доброкачественными, они могут инфильтрировать твердую мозговую оболочку, разрушать костные структуры основания черепа [1].
Распространение аденом гипофиза в полость кавернозного синуса (КС) встречается в 10–15 % случаев [6; 9; 10; 12]. Удаление опухоли из полости КС является сложной задачей для хирурга. Это связано с тем, что КС — сравнительно небольшое и труднодоступное анатомическое образование, включающее важные нейроваскулярные структуры: кавернозный сегмент внутренней сонной артерии, черепно-мозговые нервы [11].
Применение эндоскопа в транссфеноидальной хирургии позволило улучшить визуализацию операционной раны, обзор стал панорамным и хорошо освещенным. Использование оптики с разными углами зрения сделало возможным удалять опухоли «из-за угла» (в том числе и новообразования, расположенные латеральнее внутренней сонной артерии) под непосредственным визуальным контролем [2; 4; 5; 7; 8; 13].
Дальнейшее усовершенствование хирургических навыков привело к разработке расширенных транссфеноидальных эндоскопических доступов, с помощью которых стало возможным резецировать опухоли не только из полости кавернозного синуса, но и из медиальных отделов средней черепной ямки [4; 5]
МАТЕРИАЛ
В исследование включены 434 пациента c диагнозом «Аденома гипофиза», которые были оперированы в НИИ нейрохирургии имени акад. Н. Н. Бурденко с использованием методики «эндоскопической эндоназальной транссфеноидальной аденомэктомии»; все пациенты либо были успешно выписаны из стационара, либо скончались до 01 сентября 2014 г., когда был прекращен набор материала и начата его обработка. Распространение опухоли в кавернозный синус (латероселлярно) наблюдались у 90 больных (20,7 %).
Наличие инвазии опухоли в основание черепа определялась по данным дооперационных и послеоперационных КТ и/или МРТ, а также по интраоперационному мнению хирурга, отраженному в протоколе операции.
Контрольное обследование пациента в поликлинике НИИ нейрохирургии проводится через несколько месяцев (обычно через 4–6 мес) и включает в себя выполнение МРТ, исследование гормонов крови, осмотр нейроофтальмолога, отоневролога, эндокринолога, невролога, нейрохирурга и, при необходимости, радиолога.
АНАТОМИЯ ЛАТЕРОСЕЛЛЯРНОГО ПРОСТРАНСТВА
По бокам от гипофиза располагается латероселлярное пространство, которое представлено кавернозным синусом.
Кавернозный синус — это неправильной формы четырехугольная призма длиной около 2 см и шириной около 1 см (рис. 1). Парный КС является одним из крупных венозных коллекторов основания черепа, образуя боковые стенки гипофизарной ямки. Он получает венозную кровь от орбиты — в него впадают центральная вена сетчатки, верхняя и нижняя глазные вены, которые в свою очередь, анастомозируют с лицевыми венами. В синус также впадают поверхностная средняя и нижняя мозговые (сильвиевые) и средняя оболочечная вены, вены гипофизарной ямки и клиновидно-теменной синус.
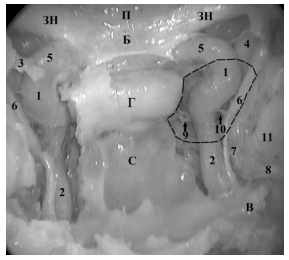
Рис. 1. Анатомический препарат (0º эндоскоп). Трепанирована задняя стенка клиновидной пазухи. Гипофиз (Г) занимает центральное положение, книзу от него располагается костное вдавление — скат (С), сверху от гипофиза располагается бугорок турецкого седла (Б) и площадка клиновидной кости (П). Зрительные нервы (ЗН) в одноименном канале расположены по бокам от площадки клиновидной кости. Кавернозные синусы (выделены пунктирной линией) располагаются с двух сторон от гипофиза. Канал видиева нерва (В) является основным ориентиром для определения местоположения паракливального отдела ВСА (2). Проксимальное дуральное кольцо (3) ограничивает параклиноидный отдел ВСА (5). В полости кавернозного синуса располагается кавернозный отдел ВСА (1) и отводящий нерв (6). Кровоснабжение гипофиза осуществляется с помощью менинго-гипофизарного ствола (9), черепно-мозговые нервы кровоснабжаются из латерального ствола (10). Латеральнее VI черепно-мозгового нерва в боковой стенке КС располагается глазной нерв, который вместе с III и VI черепно-мозговыми нервами через верхнюю глазничную щель (4) входят в полость орбиты. Непосредственно снизу и латеральнее от КС располагается меккелева полость и расположенный в ней ганглий тройничного нерва (7); верхнечелюстной (11) и нижнечелюстной (8) нервы проходят между листками ТМО медиального отдела СЧЯ
Через систему каменистых синусов (верхний и нижний) осуществляется отток венозной крови из кавернозного в сигмовидный синус и далее в яремную луковицу. Кроме того, имеется сообщение КС с венозной сетью ската, а через систему венозных выпускников — и со сплетением подвисочной ямки и носоглотки.
Кавернозный синус содержит кавернозный сегмент ВСА, окруженный волокнами симпатического сплетения, отводящий нерв (VI) и систему венозных полостей различного строения. В латеральной стенке кавернозного синуса проходят глазодвигательный нерв (III), блоковый нерв (IV) и первая ветвь тройничного нерва — глазной нерв (V1). Верхнечелюстной (V2) и нижнечелюстной (V3) нервы проходят между двумя листками ТМО латеральнее и ниже кавернозного синуса (рис. 2).
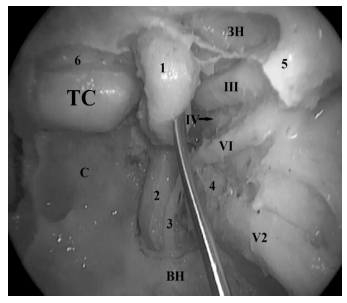
Рис. 2. Латероселлярное пространство — анатомический препарат (0º эндоскоп). Кавернозный сегмент ВСА (1) смещен медиально. Визуализируется латеральная стенка КС с проходящими в ней черепно-мозговыми нервами: 1 — кавернозный сегмент ВСА; 2 — паракливальный отдел ВСА; 3 — симпатическое сплетение ВСА; 4 — ганглий тройничного нерва; 5 — верхняя глазничная щель; 6 — межкавернозный синус; ТС — гипофиз; ЗН — зрительный нерв; ВН — крыловидный (видиев) нерв; III — глазодвигательный нерв; IV — блоковый нерв; VI — отводящий нерв, за которым располагается первая ветвь тройничного нерва; V2 — вторая ветвь тройничного нерва (верхнечелюстной нерв)
III и IV нервы входят в кавернозный синус через верхнюю стенку, покрываются глубоким листком ТМО и располагаются на латеральной стенке синуса.
V1 — первая ветвь тройничного нерва входит в латеральную стенку синуса из Меккелевой полости.
VI нерв, иногда в виде нескольких ветвей, попадает в кавернозный синус из Дореллова канала, далее проходит медиальнее Меккелевой полости и продолжается далее в переднем отделе кавернозного синуса, обычно располагаясь книзу и латеральнее внутренней сонной артерии (рис. 3).
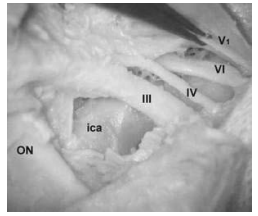
Рис. 3. Пространственное расположение черепных нервов в области боковой стенки кавернозного синуса справа. Пинцетом приподнята первая (лобная) ветвь тройничного нерва (V1) и под ним, в полости кавернозного синуса, латерально от внутренней сонной артерии (ica) расположен отводящий нерв (VI)
III, IV, V1, VI нервы из полости кавернозного синуса направляются в орбиту сквозь верхнюю глазничную щель.
В кавернозном синусе ВСА разделяют на заднюю вертикальную, горизонтальную и переднюю вертикальную части, между которыми расположены два изгиба — задний и передний, что и предает ей форму сифона (рис. 4).
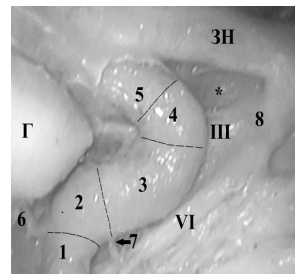
Рис. 4. Кавернозный сегмент ВСА — анатомический препарат (45º эндоскоп). Пунктирной линией разделены сегменты ВСА в КС: 1 — задняя вертикальная часть; 2 — заднее колено; 3 — горизонтальная часть; 4 — переднее колено; 5 — передняя вертикальная часть. Г — гипофиз; ЗН — зрительный нерв; VI — n. abducens; III — n. oculomotorius, 6 — менинго-гипофизарный ствол; 7 — нижнее-боковой ствол; 8 — верхняя глазничная щель; * — оптико-каротидный карман
В полости кавернозного синуса от ВСА отходят несколько артериальных стволов, наиболее постоянным из которых являются менинго-гипофизарный и нижне-боковой (рис. 5).
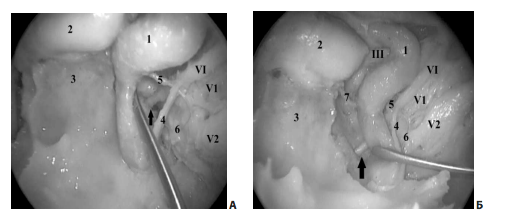
Рис. 5. Латероселлярное пространство (анатомический препарат): А — вид с помощью 0º эндоскопа; Б — вид с помощью 45º эндоскопа; 1 — кавернозный сегмент ВСА; 2 — гипофиз; 3 — скат; 4 — симпатическое нервное сплетение ВСА; 5 — нижне-боковой артериальный ствол; Б — ганглий тройничного нерва; 7 — менинго-гипофизарный артериальный ствол; III — глазодвигательный нерв; VI — отводящий нерв; V1 — глазной нерв (первая ветвь тройничного нерва); V2 — верхнечелюстной нерв (вторая ветвь тройничного нерва); стрелкой указано место входа отводящего нерва в полость кавернозного синуса из канала Дорелло.
Отводящий нерв входит в кавернозный синус из канала Дорелло и обычно располагается латеральнее ВСА на уровне верхнего края глазного нерва. Стоит отметить, что сосудистое сплетение ВСА, поднимаясь вдоль паракливального отдела ВСА, доходит до отводящего нерва, что может являться ориентиром для обнаружения VI ч.м.н. при осуществлении транссфеноидального доступа к кавернозному синусу через его передне-нижние отделы (рис. 5).
МЕТОДЫ
Оценка эффективности хирургического лечения
Для оценки эффективности хирургического лечения оценивались следующие показатели: динамика основных клинических синдромов (нейроофтальмологическая симптоматика, неврологический и гормональный статус), радикальность операции, частота и характер послеоперационных осложнений, послеоперационная летальность.
Оценка радикальности удаления опухоли
Степень радикальности проведенной операции определялась на основании анализа операционного протокола (субъективное мнение хирурга) и данных послеоперационных КТ/МРТ, проведенных через несколько месяцев после операции (обычно через 3 5 мес). При гормональноактивных опухолях учитывались данные послеоперационных исследований уровня гормонов. Используемая нами схема оценки радикальности проведенной операции аналогична схемам, используемым рядом зарубежных авторов [9, 10].
Тотальным удалением опухоли мы называли результаты тех операций, когда ни по интраоперационному мнению хирурга, ни по данным послеоперационных КТ/МРТ не было обнаружено явных послеоперационных остатков опухоли. При тотальном удалении гормонально-активной опухоли происходит нормализация уровня повышенных до операции гормонов.
При субтотальном удалении опухоли объем неудаленной части опухоли не превышает 20 % от первоначального объема опухоли. Те случаи, когда по данным КТ/МРТ явных остатков опухоли не наблюдалось, но нормализации уровня гормонов добиться не далось, были отнесены к субтотальному удалению.
Парциальным удалением опухоли мы называли случаи, когда во время операции было удалено менее 80 % объема первоначальной опухоли.
Методы хирургического лечения
Основная группа больных оперирована при помощи методики эндоскопической эндоназальной транссфеноидальной аденомэктомии, описанной Jho и Cappabianca с использованием 0º, 30º, 45º, 70º ригидных 4 мм эндоскопов без использования микроскопа, носорасширителя и послеоперационной тампонады полости носа [5; 9; 10].
Методика эндоскопического транссфеноидального удаления аденом гипофиза
Использование эндоскопов с различными углами зрения (0 °, 30 °, 45 °, 70 °) дает возможность широкой визуализации не только эндо-, но и экстраселлярных пространств в условиях хорошей освещенности операционного поля, что особенно важно и полезно при манипуляциях в латероселлярном пространстве.
Удаление опухоли из полости кавернозного синуса производится под непосредственным визуальным контролем эндоскопов с углами поля зрения от 0 ° до 70 ° с использованием различных загнутых отсосов и кюреток через дефекты в медиальной стенке кавернозного синуса.
При стандартной микрохирургической трансназальной операции визуализация кавернозного синуса и его содержимого в прямой видимости микроскопа была практически невозможна; опухоль из полости синуса удалялась «на ощупь». В некоторых случаях хирургам удавалось ощутить инструментом плотный пульсирующий тяж в полости синуса — внутреннюю сонную артерию. При микрохирургическом трансназальном удалении латероселлярной части опухоли доступны нижне-медиальные отделы опухоли, возможность удаления верхне-латеральных отделов опухоли была ограничена.
Во время эндоскопической операции за счет возможности непосредственного визуального контроля, как за ходом внутренней сонной артерии, так и за рабочим инструментом в полости кавернозного синуса, значительно повышается и радикальность удаления опухоли и безопасность операции; снижается вероятность повреждения сосудисто-нервных образований кавернозного синуса.
Естественно, что при внедрении опухоли в полость кавернозного синуса нормальная анатомия изменяется. Чаще всего аденомы гипофиза проникают в просвет кавернозного синуса через его медиальную стенку. Заполнив полость синуса, опухоль может распространяться за его пределы через щелевидные отверстия, которые являются естественными входными путями для глазодвигательного, блокового и отводящего черепных нервов. При этом аденомы гипофиза в процессе роста в полость синуса чаще всего вызывают смещение внутренней сонной артерии, глазодвигательного нерва и блокового нерва вверх и кнаружи, а отводящий нерв вместе с первой ветвью тройничного нерва — латерально и книзу. Внутренняя сонная артерия может быть смещена опухолью как к латеральной стенке кавернозного синуса (более удобный вариант), так и к средней линии — медиально (рис. 6).
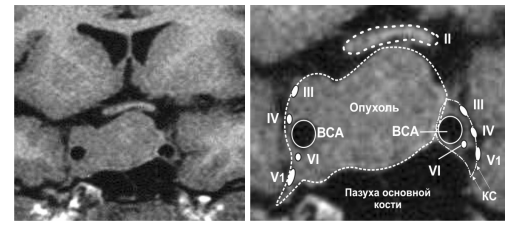
Рис. 6. Схема пространственного расположения хиазмы, внутренних сонных артерий и нервов, проходящих в кавернозном синусе с эндо-супралатероселлярной аденомой гипофиза
Второй вариант менее благоприятен. До последнего времени медиальное смещение сонной артерии вообще рассматривалось как противопоказание для проведения траснсфеноидального удаления опухоли.
Однако использование эндоскопа позволяет проводить операции даже при самом неудобном варианте смещения сонной артерии.
Естественно, что еще на дооперационном этапе хирург должен планировать тактику своих манипуляций в кавернозном синусе, для этого необходимо иметь данные об особенностях прохождения сонной артерии в кавернозном синусе (направление и степень смещения различных участков сосуда). Эти данные возможно получить проанализировав результаты дооперационных МРТ и ангиографических исследований.
Если опухоль в полости синуса достаточно мягкая, то ее удается довольно радикально оттуда удалить, при этом приходится использовать все возможные «входы» в синус вокруг сонной артерии. Если опухоль в полости синуса плотная и/или очень кровоснабженная, то попыток активных манипуляций в полости синуса мы обычно не предпринимали.
Нервы, проходящие в латеральной стенке кавернозного синуса во время операции, удается точно локализовать крайне редко — латеральная стенка кавернозного синуса становится доступной для обзора в самом конце оперативного вмешательства, если опухоль удалена более или менее радикально, но и повредить эти нервы во время операции достаточно сложно (в отличие от всех вариантов транскраниальных вмешательств, когда латеральная стенка кавернозного синуса — это то образование, через которое и происходит удаление опухоли) (рис. 7).
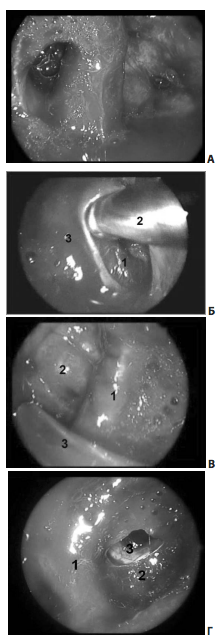
Рис. 7. Удаление опухоли из правого кавернозного синуса (45º эндоскоп): А — синими стрелками показана возможность осуществления манипуляций с обеих сторон сонной артерии; Б Б — удаление опухоли из правого кавернозного синуса (45º эндоскоп): 1 — правая ВСА; 2 — отсос; 3 — медиальная стенка правого кавернозного синуса; В В — удаление опухоли из левого кавернозного синуса (45º эндоскоп): 1 — левая ВСА; 2 — оболочка верхних отделов латероселлярного узла опухоли; 3 — отсос; Г Г — полость правого кавернозного синуса. Доступ через медиальную стенку синуса: 1 — интракавернозный сегмент правой ВСА; 2 — полость кавернозного синуса медиальнее правой ВСА; 3 — через дефект в капсуле виден правый глазодвигательный нерв
Отводящий нерв, расположенный немного латеральнее сонной артерии, удается увидеть во время манипуляций в полости кавернозного синуса достаточно часто, в большинстве случаев его удается сохранить.
В ряде случаев от верхнего полюса кавернозного синуса отходят вторичные узлы опухоли, которые также доступны для удаления во время эндоскопического вмешательства (рис. 8).
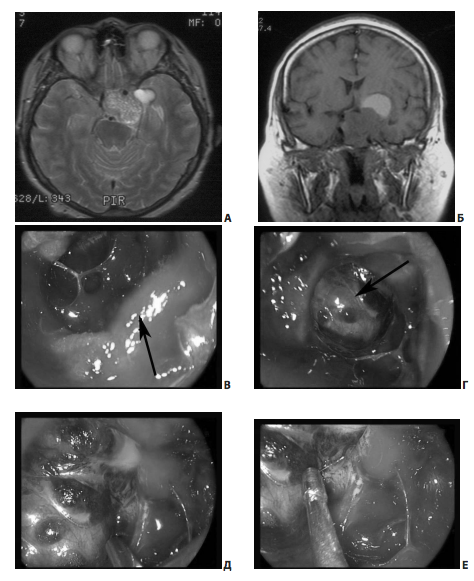
Рис. 8. Пример удаления эндо-супра-латероселлярной аденомы (от кавернозного синуса отходит вторичный узел опухоли): А, Б — МРТ до операции; В — интраоперационное фото; стрелкой указано переднее колено левой сонной артерии; Г — интраоперационное фото; стрелкой указана полость вторичного узла; Д, Е — интраоперационное фото; этапы удаления опухоли из полости вторичного узла
Опасность повреждения внутрикавернозной части сонной артерии при манипуляциях в кавернозном синусе, пожалуй, является основным фактором, ограничивающим возможности эндоскопических транссфеноидальных вмешательств.
В полости кавернозного синуса от внутренней сонной артерии отходят несколько артериальных стволов, наиболее постоянными из которых являются менинго-гипофизарный и нижне-боковой. Их повреждение (наряду с повреждением самой сонной артерии) может вызвать образование псевдоаневризм или каротидно-кавернозного соустья (рис. 9).
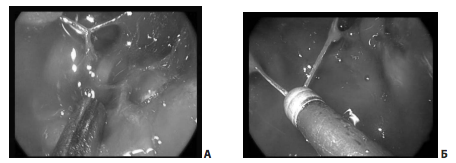
Рис. 9. А — менинго-гипофизарный ствол, отходящий от сонной артерии; Б — коагуляция менинго-гипофизарного ствола
Нередко удаление опухоли из полости кавернозного синуса сопровождается массивным и зачастую трудно контролируемым кровотечением (как венозным, так и артериальным). В этих случаях необходима слаженная работа хирурга и ассистента, в ряде случаев интенсивность кровотечения такова, что один отсос не справляется с объемом кровотечения — возникает необходимость использования двух хирургических отсосов.
Конечно, в идеале надо стремиться избежать во время операции кровотечения совершенно, но добиться этого удается далеко не всегда. Поэтому надо быть готовым к интенсивному кровотечению из кавернозного синуса и владеть всеми способами остановки кровотечения в условиях узкой и глубокой раны.
Для остановки кровотечения (как в полости кавернозного синуса, так и вообще в полости удаленной опухоли) применяются все доступные средства для местного гемостаза: ватники, смоченные перекисью водорода, гемостатическая марля, губка, пластины Tachocomb ® (Nycomed), эндоназальная моно- и биполярная коагуляция. Однако мы стараемся избегать использования без крайней на то нужды коагуляции в полости седла и полости кавернозного синуса (особенно монополярной).
К сожалению, широко распространенные за рубежом эффективные средства местного гемостаза (Tissuflease® Baxter и др.) в Российской Федерации пока не сертифицированы и в настоящее время нам не доступны.
Кроме того, пациенты, у которых существует вероятность значительной кровопотери (а, естественно это и больные с латероселлярным распространением опухоли), требуют особого внимания со стороны анестезиолога, у них обязательно должны использоваться эффективные кровосберегающие методики, такие как острая изоволемическая гемодилюция или аппаратная реинфузия эритроцитов.
При интенсивном кровотечении возможна трансфузия свежезамороженной плазмы, внутривенное введение ингибиторов сериновых протеаз (Гордокс), ингибиторов фибринолиза (ЭАКК), а также применение активированного рекомбинантного VII фактора (препарат «Новосевен», НоваНордиск, Швеция). Хотя опыт применения последнего препарата в нейрохирургии крайне ограничен, но даже первые результаты являются весьма обнадеживающими.
Как уже было сказано, в стандартной ситуации удаление опухоли из полости кавернозного синуса производится через дефекты в медиальной стенке синуса. Помимо этого, возможно осуществление гораздо более сложного латерального расширенного транссфеноидального доступа, когда удаление опухоли производится через переднюю стенку кавернозного синуса латеральнее от интракавернозного отдела внутренней сонной артерии. Особенности этого доступа будут рассмотрены в одном из последующих разделов данной работы.
Нередко вторичные узлы опухоли отходят не от супраселлярной части, а от раздутого аденомой кавернозного синуса. В этих случаях удаление вторичных узлов становится возможным лишь после более или менее радикального удаления аденомы из полости кавернозного синуса (рис. 10).
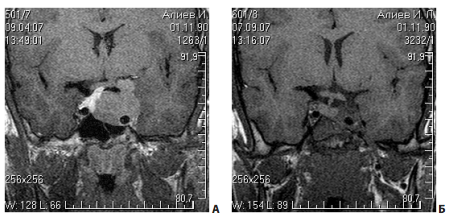
Рис. 10. Пример удаления эндо-супра-латероселлярной аденомы: А — МРТ до операции; от верхней стенки синуса отходит вторичный узел опухоли; Б — МРТ после операции; явных остатков опухоли не определяется
Все манипуляции в полости кавернозного синуса целесообразно осуществлять под контролем 30º, 45º и 70º эндоскопов; 30º эндоскоп применим для резекции опухоли из задних и задне-верхних отделов синуса, 45º эндоскоп удобно использовать при удалении опухоли из задне-нижних и средних отделов кавернозного синуса, а 70º эндоскоп необходим для удаления самой латеральной и самой передней частей опухоли.
При этом эндоскоп и инструменты порой необходимо вводить через контрлатеральную ноздрю по диагонали (особенно при удалении самой латеральной порции или самой передней части опухоли из полости синуса).
На рис. 11 представлен пример удаления гигантской эндо-супра-латероселлярной аденомы гипофиза — от задне-верхних отделов левого кавернозного синуса формировался крупный вырост опухоли с признаками старого кровоизлияния в него
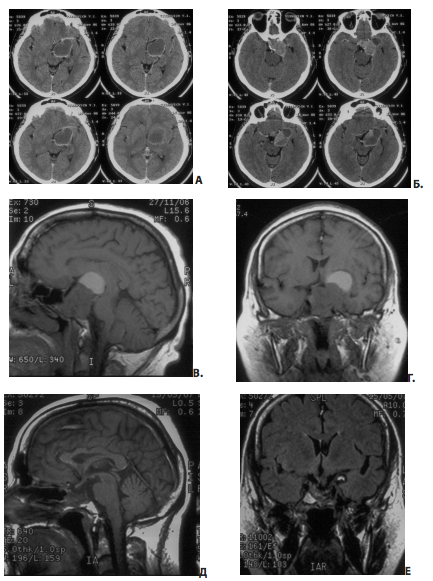
Рис. 11. Пример удаления гигантской эндо-супра-латероселлярной аденомы: А, Б — КТ до операции; В, Г — МРТ до операции, Д, Е — МРТ через несколько месяцев после операции
Первым этапом была удалена эндо-супраселлярная часть опухоли под контролем 0 и 30-градусных эндоскопов. Затем под контролем 45º и 70º эндоскопов опухоль удалена из полости левого кавернозного синуса, в задних отделах синуса обнаружен вторичный узел опухоли, из его полости выделилось некоторое количество темно-бурой жидкости, после чего со стенок вторичного узла удалено небольшое количество опухоли (рис. 11, 12). При контрольной МРТ через несколько месяцев после операции явные остатки опухоли, в том числе и в полости кавернозного синуса, не определяются. Стрелкой указана складка капсулы удаленного вторичного узла.На рис. 13 представлен пример удаления большой эндо-супра-латероселлярной аденомы гипофиза. Однако, по данным контрольной КТ в первые сутки после операции, можно лишь сказать, что нами была удалена большая часть опухоли, но судить о том, есть ли остатки аденомы и какого они размера, достаточно сложно.
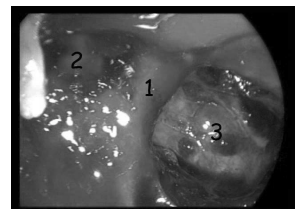
Рис. 12. Интраоперационный снимок этапа удаления гигантской эндо-супра-латероселлярной аденомы (45º эндоскоп): 1 — проекция левого зрительного нерва; 2 — капсула супраселлярного отдела опухоли; 3 — задне-верхние отделы левого кавернозного синуса
В данном случае радикальность проведенной операции была нами оценена как «субтотальная» (хирурги, осматривая полость кавернозного синуса во время операции, не видели явные остатки опухоли), однако вполне вероятно, что после получения результатов контрольного МРТ-исследования нам придется изменить наше суждение (в ту или другую сторону).
Если нам когда-либо будет доступно осуществление интраоперационного МРТисследования (а данная методика, несмотря на довольно высокую стоимость, получает во всем мире все большее распространение), то мы сможем не только гораздо более точно оценивать радикальность проведенной операции во время самого вмешательства, но и сразу же проводить дополнительную резекцию опухоли.
На рис. 14 представлен другой пример частичного удаления большой эндо-супра-латероселлярной аденомы гипофиза. По данным контрольной КТ на вторые сутки после операции, можно лишь сказать, что хирург удалял опухоль из синуса, однако очевидно, что удалена была не вся аденома, что также подтверждается субъективным мнением хирурга, отраженным в протоколе операции — плотные фрагменты аденомы, фиксированные к капсуле и стенкам сонной артерии, не удалялись.
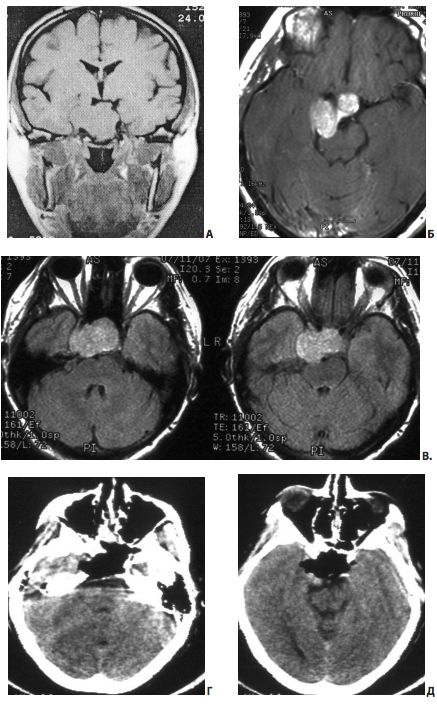
Рис. 13. Пример субтотального (?) удаления большой эндо-супра-латероселлярной аденомы гипофиза: А, Б, В — МРТ до операции; Г, Д — КТ в первые сутки после операции
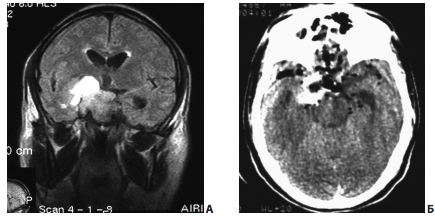
Рис. 14. Пример частичного (?) удаления большой эндо-супра-латероселлярной аденомы гипофиза: А — МРТ до операции; Б — КТ на вторые сутки после операции — в полости вторичного узла кровь, гемостатические материалы, остатки опухоли; оценить радикальность проведенной операции по данным КТ сложно
По данным контрольной КТ, произведенной не сразу после операции, достаточно сложно судить о радикальности проведенной операции — в образовавшейся полости скапливается кровь, кровью пропитываются гемостатические материалы, имбибируются остатки опухоли (рис. 14, Б).
А вот если контрольная КТ проводится в первые часы после операции, то по ее результатам вполне возможно судить о радикальности резекции аденомы.
Конечно, относительно безопасные манипуляции возможны в полости синуса лишь при не очень плотных и не очень кровоточивых опухолях. При опухолях высокой плотности и/или очень кровоснабжаемых аденомах риск повреждения интракавернозной порции внутренней сонной артерии при попытках резекции латероселлярной части аденомы представляется неоправданно высоким. Однако, все-таки опухоли, распространяющиеся в полость кавернозного синуса, по нашему опыту чаще бывают средней плотности и умеренной кровоточивости.
Несмотря на достаточно успешное в ряде случаев использование эндоскопической техники при врастании опухоли в полость кавернозного синуса, манипуляции хирурга ограничены (помимо плотности и кровоточивости аденомы) положением интракавернозного отдела внутренней сонной артерии — артерия может быть смещена опухолью латерально или медиально, а может находиться на месте; а также степенью распрямления изгибов интракавернозного отдела сонной артерии (между которыми и возможно войти отсосами и кюретками в полость кавернозного синуса).
Радикальное удаление порции опухоли, расположенной латеральнее сонной артерии (в тех случаях, когда артерия обращена аденомой со всех сторон, рис. 15) возможно далеко не всегда; в большей степени это относится к части аденомы, расположенной в передних отделах кавернозного синуса (особенно в передне-нижних).
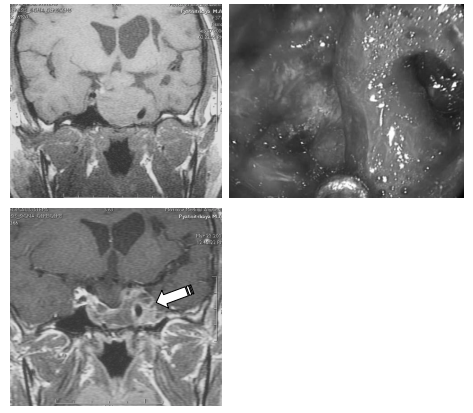
Рис. 15. Пример субтотального удаления эндо-супра-латероселлярной соматотропиномы: А — МРТ до операции; Б — интраоперационное фото (30; эндоскоп) — сонная артерия в полости кавернозного синуса обращена опухолью со всех сторон; В — МРТ после операции; после операции уровень СТГ в норме, но латеральнее ВСА — остаток опухоли
Достаточно успешное удаление опухоли из задне-верхних и задне-нижних отделов кавернозного синуса достигается заметно чаще даже при выраженной инвазии аденомы в полость синуса. Удаление опухоли при умеренной инвазии опухоли (когда опухоль обрастает лишь медиальную стенку внутренней сонной артерии, см. рис. 16) в полость синуса, также обычно не составляет значительной сложности.
Из данных табл. 1 следует, что количество тотальных резекций аденом гипофиза при их врастании в полость кавернозного синуса заметно ниже, чем при отсутствии латероселлярного распространения опухоли. Эти показатели различаются статистически высоко достоверно (р<0,00001).

Количество тотальных удалений опухоли при врастании аденомы в синус приблизительно равно количеству субтотальных и частичных резекций, эти показатели нам представляются вполне приемлемыми. Хотя, конечно, лишь использование эндоскопической техники во время стандартных транссфеноидальных операций или во время так называемых «расширенных» доступов (о которых будет рассказано в последующих разделах работы) ни в коем случае не может решить все проблемы хирургии кавернозного синуса.
Зрительные нарушения
Зрительные расстройства различной степени выраженности были отмечены у 243 из 434 пациентов (56 %). У большинства пациентов именно зрительные расстройства были основным, а зачастую и единственным, проявлением заболевания. Именно желание улучшить зрение или хотя бы стабилизировать имеющиеся нарушения зрения были основной целью хирургического лечения для значительного количества пациентов.
Глазодвигательные нарушения
Глазодвигательные нарушения до операции были выявлены у 29 пациентов из тех 434, кому было проведено эндоскопическое эндоназальное транссфеноидальное удаление аденомы гипофиза. Глазодвигательные нарушения были выявлены у 15,6 % (14 из 90) больных, у которых опухоль распространялась в полость кавернозного синуса и лишь у 4,4 % (15 из 344) пациентов без явного распространения опухоли в кавернозный синус. Глазодвигательные нарушения появляются при распространении аденомы в полость кавернозного синуса, развиваются статистически высоко достоверно чаще (р=0,00015), чем без распространении опухоли в синус.
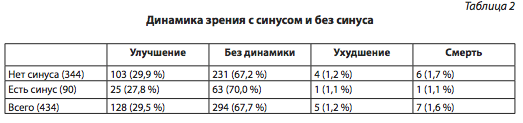
В табл. 3 представлена динамика глазодвигательных расстройств в зависимости от наличия инвазии опухоли в полость кавернозного синуса.
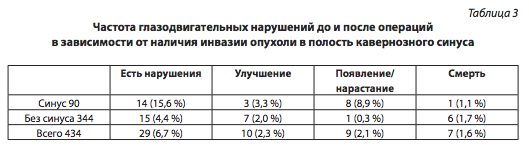
Появление/нарастание глазодвигательных расстройств после операции обычно связано с манипуляциями хирурга в полости кавернозного синуса, так чаще всего было и в нашем материале. В 8 из 9 случаев глазодвигательные нарушения появились (ни у одного из этих пациентов до операции не было глазодвигательных нарушений) после более или менее успешных попыток удаления опухоли из полости кавернозного синуса. В 3 случаях отмечено появление недостаточности 3-го нерва; в 5 случаях появилась недостаточность функции 6-го нерва со стороны того синуса, где осуществлялись манипуляции.
Как мы видим, появление недостаточности отводящего нерва происходит несколько чаще, чем недостаточности глазодвигательного нерва. Объяснить это можно тем, что при транссфеноидальном доступе к опухоли глазодвигательный нерв (расположенный в латеральной стенке кавернозного синуса) повредить во время операции хирургическим инструментом сложнее, чем отводящий нерв, расположенный латеральнее сонной артерии, но более медиально, чем глазодвигательный нерв. Функциональное повреждение глазодвигательных нервов обычно возникает как следствие имбибиции кровью гемостатических материалов и/или остатков опухоли в полости кавернозного синуса; функциональные нарушения обычно регрессирует через 2–3 мес после операции.
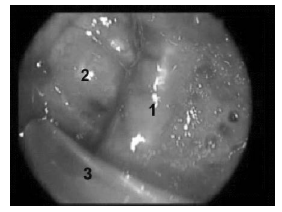
Рис. 16. Этап удаления опухоли из полости кавернозного синуса. Удаление опухоли при умеренной инвазии аденомы в кавернозный синус (опухоль обрастает лишь медиальную часть сонной артерии): 1 — сонная артерия; 2 — латеральная стенка кавернозного синуса; 3 — отсос
Таким образом, частота появления/нарастания глазодвигательных расстройств у пациентов после эндоскопического удаления опухолей гипофиза, врастающих в кавернозный синус, составила в нашем материале 8,9 % (8 из 90 пациентов).
Аналогичные данные были получены в 2003 г. М.А. Кутиным [6], проведшим сравнительный анализ эффективности различных методов хирургического лечения пациентов с аденомами гипофиза, инфильтировавших кавернозный синус; по его данным, появление глазодвигательных нарушений было отмечено у 12 из 149 пациентов, оперированных транссфеноидально (8,1 %).
Лишь в 1 случае, когда ни по данным дооперационных исследований, ни по интраоперационным данным не было отмечено врастания опухоли в полость синуса, после операции появилась недостаточность 6-го нерва (интраоперационно у этого пациента было отмечено выраженное венозное кровотечение из полости синуса, остановленное местными гемостатическими материалами). В данном случае появление глазодвигательных нарушений можно объяснить механическим сдавлением кавернозного синуса гемостатическими материалами. Появившиеся нарушения полностью регрессировали через несколько месяцев к моменту контрольного обследования в поликлинике ИНХ.
Частота появления глазодвигательных расстройств после удаления опухолей, распространяющихся в кавернозный синус — 8 из 90 (8,9 %) статистически высоко достоверно (р<0,0001) отличается от частоты развития глазодвигательных расстройств после удаления аденом, которые не распространялись в полость синуса — 1 из 344 (0,3 %).
Из 9 пациентов, у которых после операции развились глазодвигательные нарушения, 6 уже были на контрольном обследовании в поликлинике ИНХ и у всех этих пациентов глазодвигательные расстройства полностью регрессировали.
У ряда пациентов (15 из 344–4,4 %) было отмечено наличие глазодвигательных до операции при отсутствии явного врастания опухоли в полость кавернозного синуса. Объяснить это возможно также наличием механического сдавления кавернозного синуса и сосудисто-нервных образований, локализованных в кавернозном синусе опухолью, находящейся в полости турецкого седла. Причем у 7 из этих 15 пациентов (46,7 %) после успешного удаления опухоли из полости седла сразу после операции глазодвигательные расстройства в значительной мере регрессировали.
Положительная динамика глазодвигательных нарушений была отмечена сразу после эндоскопического удаления опухоли из полости кавернозного синуса у 3 пациентов из 14 (21,4 %).
Таким образом, улучшение функции глазодвигательных нервов отмечено, а нашем материале у 10 пациентов из всех 434 (2,3 %); или у 10 из 29, имевших глазодвигательные расстройства до операции (34,5 %). Аналогичные данные были получены и Н.Н. Григорьевой [3], которая отмечала в своем материале уменьшение степени выраженности глазодвигательных нарушений после операции у 6 пациентов из 371 (1,6 %) или у 6 из 18, имевших глазодвигательные нарушения до операции (33,3 %).
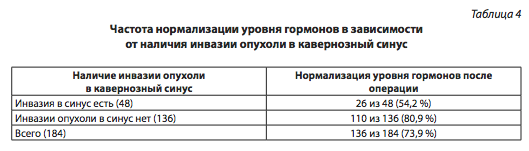
Динамика гормонов
Нормализация уровня гормонов крови после удаления опухолей, инвазирующих кавернозный синус, в нашем материале была отмечена только у 26 пациентов из 48 (54,2 %) и у 110 из 136 (80,9 %), у которых инвазии опухоли в кавернозный синус не было (табл. 4). Эти показатели различаются статистически высоко достоверно (р=0,00029).
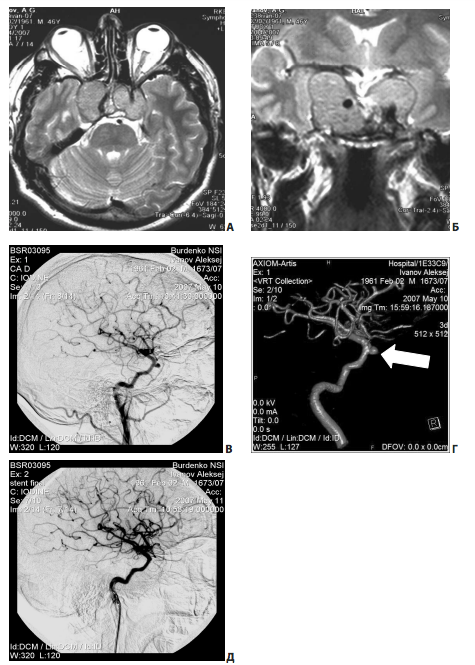
Рис. 16. Пример повреждения интракавернозного отдела левой сонной артерии на этапе удаления опухоли из полости кавернозного синуса: А, Б — МРТ до операции (большая эндо-супра-латероселлярная аденома гипофиза); В, Г — ангиография через несколько дней после операции; ложная аневризма указана стрелкой; Д — ангиография после эндоваскулярной операции
Повреждения интракавернозной части внутренней сонной артерии
Повреждение интракавернозного отдела внутренней сонной артерии является одним из наиболее опасных осложнений транссфеноидальной хирургии (как микроскопической, так и эндоскопической). Сонную артерию возможно повредить в двух случаях: либо на этапе доступа к опухоли при трепанации дна турецкого седла, если хирург слишком отклонился латерально от верной траектории, либо при манипуляциях в полости кавернозного синуса.
Клинический пример (рис. 17).
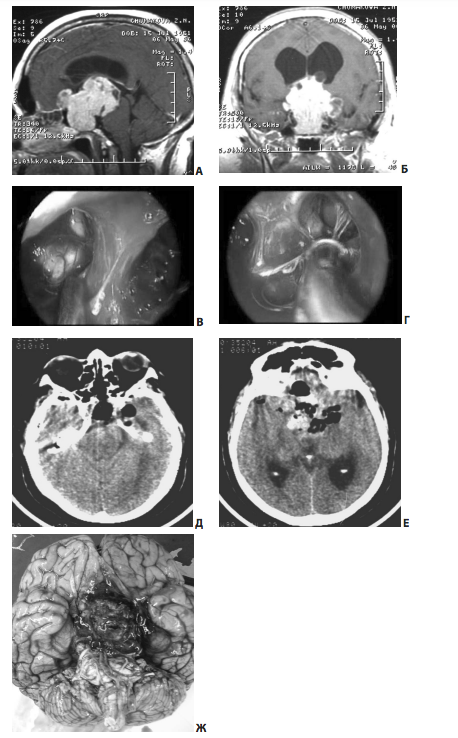
Рис. 18. Пример парциального удаления гигантской многоузловой аденомы гипофиза: А, Б — МРТ до операции; В, Г — капсула опухоли отсутствует, выделение сосудов и нервов из складок между узлами; Д, Е — КТ после операции — кровоизлияние в остатки опухоли; Ж — фото во время вскрытия умершей пациентки
Повреждение правой ВСА произошло на этапе гемостаза, после удаления опухоли из полости кавернозного синуса. При ангиографии, выполненной сразу после операции, явных признаков повреждения внутренней и наружной сонных артерий, указывающих на источник кровотечения, выявлено не было. Формирование ложной аневризмы было обнаружено при повторной ангиографии, на 8-е сут после операции (рис. 17, В, Г). По данным ангиографии, выявлены гипопластичные правые А1 и Р1. В данных условиях проводить окклюзию ВСА было нельзя. Этому пациенту был установлен стент-графт на 9-е сут после операции (рис. 17, Д). Пациент был выписан без нарастания очаговой неврологической симптоматики.
Опасность повреждения внутрикавернозной части сонной артерии при манипуляциях в кавернозном синусе, пожалуй, является основным фактором, ограничивающим возможности транссфеноидальных вмешательств.
Во время эндоскопической операции почти всегда возможно осуществлять визуальный контроль и над внутренней сонной артерией, и над инструментом в полости кавернозного синуса, естественно, что вероятность повреждения сосуда в полости синуса.
Конечно, хирурги должны планировать тактику своих манипуляций в кавернозном синусе. Для этого необходимо иметь данные об особенностях прохождения сонной артерии в кавернозном синусе (направление и степень смещения различных участков сосуда).
Конечно, в идеале надо стремиться избежать во время операции кровотечения совершенно, но добиться этого удается далеко не всегда. Поэтому надо быть готовым к интенсивному кровотечению из кавернозного синуса и владеть всеми способами остановки кровотечения в условиях узкой и глубокой раны.
Однако далеко не всегда попытки эндоскопического транссфеноидального удаления вторичных бескапсульных узлов заканчиваются без тяжелых осложнений.
На рис. 18 представлены дооперационные МРТ пациентки с гигантской аденомой гипофиза, супраселлярная часть опухоли была представлена несколькими бескапсульными узлами, обрастающими сосуды Виллизиева круга, деформирующими ствол мозга, базальные отделы лобных и височных долей, распространяющимися в 3-й желудочек. Состояние пациентки до операции тяжелое: выраженные зрительные, эндокринно-обменные и эмоционально-личностные нарушения.
Конечно, подобную опухоль невозможно удалить тотально транссфеноидальным доступом, однако подобная задача перед нами не ставилась. Целью операции было уменьшение объема опухоли для оптимизации проведения дальнейшего консервативного и лучевого лечения.
Удаление опухоли, естественно было парциальным — все сосуды и нервы на основании мозга были обращены опухолью. Смерть пациентки наступила на 54-е сут после операции; непосредственная причина смерти — острое нарушение мозгового кровообращения по геморрагическому типу (множественные очаговые кровоизлияния в стенках 3-го желудочка, зрительных буграх и ножках мозга).
ЗАКЛЮЧЕНИЕ
Врастание опухоли в полость кавернозного синуса статистически достоверно снижает частоту тотального удаления аденом гипофиза. Однако панорамный обзор операционной раны и возможность удалять опухоли «из-за угла» под непосредственным визуальным эндоскопическим контролем способствует повышению радикальности хирургического лечения аденом гипофиза с латероселлярной локализацией, снижению количества послеоперационных осложнений (уменьшает частоту повреждения глазодвигательных нервов, количество послеоперационных ликворей и т. д.) и летальных исходов.
Серьезной проблемой хирургии кавернозного синуса является риск повреждения кавернозного отдела ВСА, с целью предупреждения которого необходимо использовать различные методы навигации, в частности ультразвуковую допплерографию. Данная методика позволяет визуализировать ВСА в строме опухоли, определить безопасные границы разреза твердой мозговой оболочки в проекции кавернозного синуса.
Учитывая возможность развития менингита в послеоперационном периоде, необходимо всегда помнить об адекватной пластике образовавшихся дефектов основания черепа после операции и профилактике гнойно-септических осложнений.
Для проведения «расширенных» транссфеноидальных эндоскопических вмешательств (в том числе и для резекции опухолей латероселлярной локализации) необходим достаточный опыт хирурга в проведении стандартных эндоскопических аденомэктомий (150–200 операций) и обязательное обучение в условиях анатомической лаборатории.


