Введение
Опухолевые заболевания головного мозга представляют собой гетерогенную группу объемных образований внутричерепной локализации со злокачественным или доброкачественным характером роста и различным гистогенезом [1, 2].
Новообразования головного мозга бывают первичными и вторичными. Первичные опухоли развиваются из клеток, непосредственно локализующихся в тканях головного мозга (нейронов и нейроглии), его оболочек и черепных нервов. Вторичные опухоли имеют метастатическое происхождение. Первичные карциномы головного мозга составляют около 2 % от всех случаев злокачественных новообразований. Рак головного мозга представляет собой одну из самых сложных проблем в современной онкологической практике при его верификации и выборе тактики лечения [3].
По данным международной и национальной статистики, нейроонкологическая заболеваемость продолжает неуклонно увеличиваться. В Западной Европе, Северной Америке, Австралии заболеваемость первичными опухолями головного мозга, включая менингиомы, составляет 6–19 случаев на 100 тысяч мужского и 4–18 случаев на 100 тысяч женского населения [4].
Последние исследования Kshettry V.R., Ostrom Q.T., Lym L., De Blank P.M. и др. (2015) из Central Brain Tumor Registry of the United States (CBTRUS) показывают, что в 2004– 2008 гг. в США заболеваемость доброкачественными и злокачественными первичными опухолями головного мозга составляла 16,1 на 100 тысяч мужского и 19,2 на 100 тысяч женского населения [5, 6, 7, 8, 9, 10].
Современная классификация опухолей ЦНС (ВОЗ, 2016 г.) основана не только на патогистологической характеристике новообразования, но и на молекулярно-биологических данных, в рамках которых астроцитарные и олигодендроглиальные опухоли подразделяются в зависимости от наличия или отсутствия в геноме их клеток IDH-1 или IDH-2 мутации (рисунок) [11, 12].
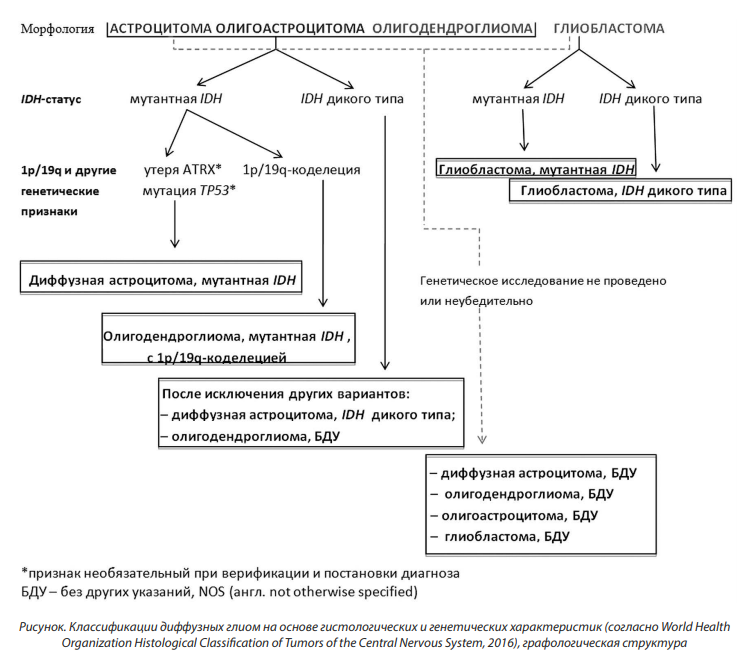
Астроцитомы составляют абсолютное большинство среди опухолей головного мозга. Наиболее распространенными формами являются диффузная астроцитома (GII), анапластическая астроцитома (GIII) и глиобластома (GIV). Диффузная астроцитома с инфильтративным компонентом характеризуется высокой степенью нейроглиальной дифференцировки, различными темпами прогрессирования, супратенториальной локализацией и способностью к малигнизации. Основными гистологическими вариантами данного вида астроцитом являются фибриллярная астроцитома, гемистоцитарная астроцитома и протоплазматичесая астроцитома. Эти виды мозговых неоплазий возникают преимущественно в молодом возрасте (до 30–40 лет), что подчеркивает актуальность обсуждаемой проблемы. Диффузные астроцитомы, по данным статистики, поражают наиболее социально и профессионально активную часть населения – 87 % пациентов моложе 35 лет [13]. Необходимо отметить, что в ряде случаев диффузные астроцитомы склонны к малигнизации с формированием анапластических астроцитом и глиобластом. При этом в 86 % случаев опухоль локализуется в больших полушариях, вызывая тяжелые, фактически инвалидизирующие изменения, сопровождаясь крайне высокой летальностью (двухлетняя выживаемость составляет 26 %) [14, 15]. Таким образом, важность ранней диагностики и определения прогностических факторов данной патологии не вызывает сомнений.
Анапластическая астроцитома представляет собой инфильтративно растущую злокачественную астроцитому, которая появляется у взрослых в больших полушариях головного мозга как следствие прогрессирования диффузных астроцитом и гистологически характеризующаяся ядерной атипией, повышением клеточности и выраженной пролиферативной активностью. Клетки опухоли иммунопозитивны для глиофибриллярного кислого белка (GFAP) [16, 17].
Наиболее часто из нейроэпителиальных (глиальных) опухолей в развитых странах встречаются глиобластомы. Заболеваемость глиобластомами в Америке и Европе варьируется в пределах 3,2–3,4 на 100 тыс. населения. Для них характерна высокая степень ядерной атипии, выраженные клеточный полиморфизм и митотическая активность. Также в ткани опухоли можно выявить тромбозы сосудов, микроваскулярную пролиферацию и широкие поля некрозов [18, 19].
Прогностические факторы
Одним из главных прогностических критериев у больных с глиомами является гистологическая фенотипическая верификация (степень злокачественности опухоли) в соответствии с рекомендацией ВОЗ (2015 г.). Поэтому тактика лечения при опухолях головного мозга, прежде всего, определяется морфологическим заключением. Другими важными прогностическими критериями для оценки состояния больного и прогноза течения заболевания являются молекулярно-генетические особенности опухоли, возраст пациента, общий статус (обычно – статус Карновского), выраженность внутричерепной гипертензии, сопутствующие заболевания. Эти факторы также в определенной степени влияют на выбор тактики лечения [16].
Стоит отметить, что надежных маркеров прогноза для пациентов с опухолевыми заболеваниями головного мозга, равно как и маркеров, определяющих чувствительность неопластического процесса к тем или иным видам лечения, а соответственно, и тактику проводимой терапии, существует крайне мало. В последнее время большие надежды в данном вопросе стали возлагаться на некоторые генетические изменения в опухолевых клетках и, в частности, формирование IDH1- и IDH2-мутантного и дикого типов. При исследовании данной проблемы выяснилось, что IDH мутация является ранним событием в процессе онкогенеза опухолей глиального происхождения и имеет серьезные последствия для прогрессии глиомы и поведения опухоли. Так, было показано, что пациенты с диффузными и анапластическими астроцитомами с наличием мутации IDH1 и глиобластомами IDH1+ демонстрируют более высокие показатели общей выживаемости, в то время, как наличие IDH1 или 2 дикого типа коррелирует с выраженным неблагоприятным прогнозом [20]. В ряде исследований было показано, что мутации IDH1 и IDH2 в опухолях низкой степени злокачественности (GII) коррелируют с более благоприятным прогнозом, нежели дикие типы данных генов [21, 22, 23, 19].
Генетические мутации (IDH1 и IDH2) в канцерогенезе головного мозга
Роль IDH1 и IDH2 мутаций в канцерогенезе и эпигенетические механизмы
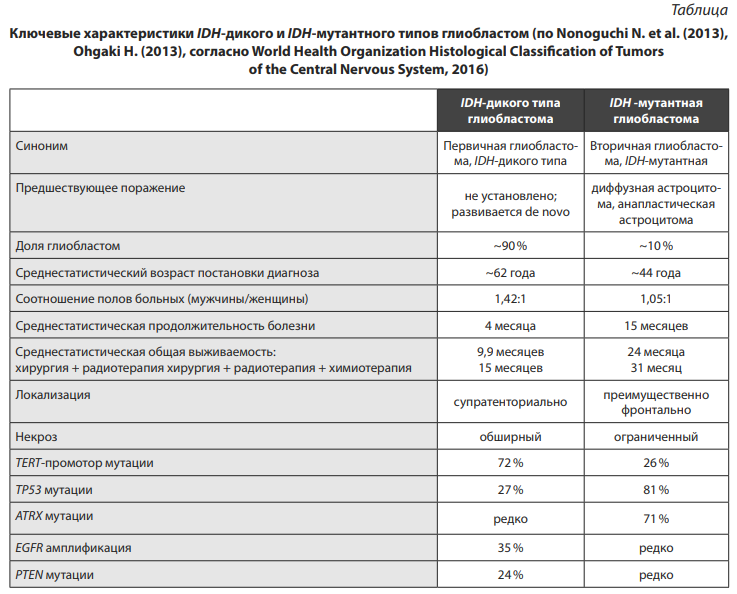
Наиболее частыми точечными мутациями гена изоцитратдегидрогеназы 1 (IDH1) и 2 (IDH2) являются R132H в первом гене и R140Q во втором гене. При этом в тех вариантах глиом, в которых имелась мутация гена IDH1, в подавляющем большинстве случаев имелась именно точечная мутация R132H (таблица) [24].
Повторяющиеся мутации IDH1 и IDH2, идентифицированные не только в глиомах головного мозга, но также при остром миелоидном лейкозе (ОМЛ) и хондросаркомах (ХС), приводят к появлению нового соединения с иными ферментативными свойствами 2-гидроксиглутарата (2Hg), формирующегося из α-кетоглутарата. Продукция 2-гидроксиглутарата индуцирует гиперметилирование ДНК и, предположительно, ингибирует туморогенез.
В сравнительном ретроспективном исследовании (n = 200 случаев) глиом IDH-дикого и IDH-мутантного типов низкой степени злокачественности Huang L.E. et al. (2016 г.) и Olar A. et al. (2015 г.) показали, что IDH-мутантные глиомы продемонстрировали повышение экспрессии генов опухолевых супрессоров (NF1, PTEN и PIK3R1) и снижение экспрессии ряда онкогенов (AKT2, ARAF, ERBB2, FGFR3 и PDGFRB) и генов прогрессии глиомы (FOXM1, IGFBP2 и WWTR1) по сравнению с глиомами IDHдикого типа. Кроме того, каждый из этих генов является в целом прогностическим для глиом, тем не менее, в рамках IDH-мутантных групп, ни один не показал своего прогностического значения, кроме IGFBP2 (кодирующего Инсулиноподобный фактор роста, связывающий белок 2 типа, IGFBP2).
При изучении в независимой группе было показано, что пациенты с низким уровнем экспрессии IGFBP2 демонстрируют явное преимущество в общей выживаемости и по количеству рецидивов, в то время как в когорте с высоким уровнем экспрессии IGFBP2 выявляется высокая медиана смертности по сравнению с IDH-диким типом у онкобольных [25, 26].
В некоторых исследованиях было выявлено, что 2Hg-продуцирующие IDH мутанты могут блокировать процесс деметилирования гистонов, который необходим для нормальной дифференцировки специфических клеток-предшественников.
В образцах опухолевой ткани больных с глиомами, IDH мутации были связаны с сильно измененным профилем экспрессии генов, усилением экспрессии ряда протоонкогенов, выраженным в нейронных клетках – предшественниках (в отличие от упомянутых выше поздних стадий развития глиомных раковых клеток), что было также связано с увеличением метилирования гистонов. IDH мутация коррелирует со значительным увеличением репрессивного метилирования гистонов без заметных изменений в метилировании промоторов генов ДНК. Вместе эти данные показывают, что 2Hg, продуцирующийся вследствие IDH мутации, может ингибировать деметилирование гистонов и что ингибирования этого процесса может быть достаточным, чтобы блокировать дифференцировку нетрансформированных клеток [27].
Влияние мутаций гена IDH на геном опухолевых клеток
В ряде работ (Wakimoto H. et al., 2014) продемонстрировано наличие корреляции между IDH дикого типа и выраженной активацией ряда протоонкогенов и индуцированием взаимосвязанных с ними биохимических компонентов, таких как PIK3CA, KRAS, AKT, N-MYC и других [28]. В одном клинико-морфологическом наблюдении с большим количеством пациентов была показана роль IDH-генов в активации процессов ангиогенеза, играющего существенную роль в прогрессировании и инвазии опухоли [29].
Некоторые работы показывают, что глиомы GII степени злокачественности с IDH диким типом по уровню мутационных модификаций генома практически неотличимы от глиобластом (GIV), что может объяснять неблагоприятный прогноз при наличии соответствующего генетического маркера [30].
Мутации IDH1 и IDH2 влияют на репарацию ДНК
Процесс репарации ДНК является одним из принципиальных механизмов антионкогенной защиты клеток. Недавно были получены интересные данные о взаимосвязи мутаций IDH1 и IDH2 с изменениями в процессах репарации ДНК опухолевых клеток. Выяснилось, что повышенная продукция 2-гидроксиглутарата (2HG), индуцированная IDH мутациями, приводит к значительному снижению активности процессов гомологичной рекомбинации, являющимся одним из ключевых факторов восстановления нативной структуры генома и представляющим собой, таким образом, важнейший компонент антионкогенной внутриклеточной защиты [30, 31].
Эндогенные (например, S-аденозилметионин, SAM) и экзогенные (например, производные нитрозомочевины) алкилирующие агенты активируют процесс метилирования оснований в мутировавших участках ДНК, не поддающихся репарации [32]. Важнейшими ферментами, участвующими в процессе репарации, являются белки семейства AlkB, которое принадлежит к Fe (II)- и α-КГ-зависимым диоксигеназам [33] и включает в себя девять различных генов [33]. Функция репарации поврежденной ДНК данными ферментами была продемонстрирована в биохимических экспериментах in vitro и при помощи генетического анализа у мутантных по генам ALKBH2 и ALKBH3 мышей и других млекопитающих [34, 35, 36]. При изучении влияния D-2-HG на активность ALKBH2 и ALKBH3 с использованием очищенных рекомбинантных ALKBH2 и ALKBH3 белков и ДНК олигонуклеотидов было обнаружено, что очищенный ALKBH2 и ALKBH3 быстро (в течение 1 мин) деметилирует (восстанавливает) мотивированный ранее аденин.
Добавление 0,5 мМ 2HG вызвало почти 50 %-ное снижение активности ALKBH2 при последующем повышении дозы вплоть до полного его ингибирования. Это согласуется с предыдущим наблюдением, показывая, что 2HG подавляет восстановление ДНК с помощью фермента ALKBH2 in vitro.
Точно так же активность ALKBH3 ингибируется 2HG. Несмотря на то, что 2HG является относительно слабым ингибитором ALKBH2 и ALKBH3 белков и не оказывает существенного влияния на ALKBH-опосредованный механизм репарации ДНК при нормальных физиологических условиях (в силу достаточно низкой, в норме, фактически следовой концентрации его в клетке), высокие уровни 2HG, накапливающегося в IDH-мутировавших глиомах (т.е. 5–35 ммоль/л) в клетках астроцитарных глиом [37, 38], позволило предположить, что это может как значительно ухудшить функцию ALKBH в IDH-мутировавших клетках, так и выражено ингибировать другие α-КГ-зависимые диоксигеназы [39].
При изучении вопроса о том, могут ли 2HG ингибировать ALKBH2 и ALKBH3 белки в опухолевых клетках, были использованы стабильные клеточные линии глиомы с экспрессией дикого типа гена IDH1 или мутантного R132H IDH1 на том же уровне, что эндогенного IDH1. Было выявлено, что мутация IDH1 приводит к значительному замедлению процессов репарации ДНК (примерно в 7 раз) и накоплению в мутированных клетках большего количества генных мутаций по сравнению с клеточной линией дикого типа данного гена. Эндогенные уровни как ALKBH2, так и ALKBH3 белков не зависели от наличия или отсутствия дикого или мутантного типа IDH1. Хотя наличие мутации IDH1 сенсибилизировало клетки к действию алкилирующего агента, клетки, экспрессирующие дикий или мутантный тип IDH1, отвечали одинаково на воздействие лучевой терапии. В совокупности, эти результаты показывают, что в опухолевых клетках, несущих мутацию IDH1, продукт мутировавшего гена ингибирует активность ALKBH ферментов и приводит к накоплению повреждений ДНК в клетках [38].
В исследованиях за последние пять лет было выявлено, что вызванные IDH1/2 мутациями нарушения гомологичной рекомбинации приводят к значительному повышению чувствительности клеток к PARP ингибиторам. Этот фенотип мутантных клеток может быть реверсирован путем обработки клеток олигонуклеотидными ингибиторами мутантного IDH1 фермента, и, наоборот, он может быть полностью воспроизведен путем обработки любым из энантиомеров 2Hg в клетках с немутировавшими IDH1/2 генами. Показано (Sulkowski P.L. et al., 2017), что мутантные IDH1-клетки проявляют значительную чувствительность к целому ряду ингибиторов PARP в диапазоне клинически значимых моделей, в том числе выявлена подобная чувствительность для первичных клеток глиом пациентов in vivo. Эти данные служат основой для создания новой стратегии консервативного лечения, использующей биологические последствия мутации гена IDH с помощью воздействия ингибиторов PARP [40].
Глиобластомы у детей (субклеточный профиль)
Глиобластомы являются одним из наиболее распространенных видов злокачественных опухолей у детей и по-прежнему остаются на первых позициях среди детской летальности от злокачественных новообразований головного мозга.
Korshunov A., Ryzhova M., Hovestadt V. et al. (2015 г.) изучали прогностическую значимость геномных и эпигенетических изменений у 202 детей с помощью молекулярного анализа (метилирование ДНК, FISH). В результате исследования было показано, что около 40 % глиом обладают низкой степенью малигнизации (плеоморфные ксантоастроцитомы). Они демонстрировали хороший прогноз и были схожи с молекулярным профилем PXA-подобных опухолей (BRAF V600E мутации и 9p21 (CDKN2A) гомозиготная делеция). Среди оставшихся 162 глиом были сформированы четыре группы: H3.3 G34-мутантный тип (15 %), H3.3/H3.1 K27-мутантный тип (43 %), IDH1-мутантный тип (6 %) и H3/IDH дикий тип (36 %) [41]. Проведенный анализ корреляции патогистологических признаков, иммунофенотипирования и молекулярно-биологического профиля, указывающий на определенные хромосомные аберрации, позволил создать панель маркеров для верификации глиом в детском возрасте [5]. Несмотря на то, что проведённое исследование отчасти позволило прогнозировать выживаемость детей с глиобластомами, молекулярно-генетические механизмы канцерогенеза остаются малоизученными.
Заключение
Резюмируя обзор специализированной литературы, следует заметить, что мутантные формы по IDH1 гену значительно медленнее прогрессируют, обладая сниженным риском малигнизации и, в целом, мутации данного гена обладают выраженным антионкогенным эффектом. При этом практически все мутации совершенно стереотипные (98,9 %) и происходят в одном и том же участке гена – мутация R132H. Кроме того, антионкогенный эффект достигается через сложные комплексные модификации эпигенетических механизмов регуляции экспрессии генома, такие как метилирование ДНК и метилирование гистонов. Процессы гиперметилирования ДНК и гистонов приводят к обширным изменениям транскриптома раковых клеток, в итоге блокирующего экспрессию протонкогенов и повышающего активность противоопухолевых генов.
Также было выявлено, что уровень генетических мутационных изменений в клетках опухолей с диким типом IDH фактически соответствует изменениям при наиболее тяжелых формах онкологического процесса, соответствующих GIV гистопатологической классификации. При этом морфологическая картина злокачественности значительно менее выражена, то есть, по сути, имеется некоторое «отставание» патогистологических изменений от уровня генетической мутированности раковых клеток.
В то же время вышеизложенные данные демонстрируют наличие мутации гена IDH, вызывающие нарушение репарации ДНК, что приводит к значительному росту нестабильности генома опухолевых клеток, стимулируя дальнейшее прогрессирование мутационного процесса.
Таким образом, суммируя имеющиеся результаты проведенных исследований, можно выдвинуть следующую гипотезу. Мутация гена IDH1 является сложным многоуровневым процессом, представляющим собой совершенно новый, ранее не описанный механизм активации антионкогенной внутриклеточной защиты.
Причина, по которой мутация возникает в опухолевых клетках de novo, не присутствуя в астроцитах нейроглии изначально, по-видимому, связана с блокированием процессов дифференцировки и развития клеток головного мозга в процессе развития, что подтверждается тяжелыми гипоплазиями головного мозга у пациентов с врожденными формами данной мутации [42, 43]. В то же время, по-видимому, данный механизм не функционирует абсолютно самостоятельно, являясь частью сложного антионкогенного процесса, способствующего замедлению опухолевой прогрессии и элиминации опухолевого клеточного клона, обуславливая значительно лучший прогноз у носителей данной мутации. По-видимому, мутация генов IDH1 и IDH2, вызывая значительное увеличение нестабильности генома, приводит к нарастанию мутационных изменений вплоть до критического уровня, нарушающего оптимальный гомеостаз опухолевой ткани и активирующий вторичные антионкогенные механизмы, которые и приводят к значительному замедлению опухолевой прогрессии.
В целом, нами описан принципиально новый механизм противоопухолевой защиты – стереотипная мутация гена, мутация же гена IDH1 является одним из ключевых событий, индуцирующих дальнейший каскад антионкогенных механизмов при глиомах головного мозга. Стоит отметить, что подобные мутации вполне могут существовать и в опухолевых клетках другой локализации, также формируя ключевой защитный барьер в борьбе с неопластическим процессом.
Конфликт интересов. Все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.


