Введение
Эпидермальная киста (ЭК), или холестеатома (греческий chole «желчь» + stear, steatos «сало, жир» + -oma; синоним: эпидермоид, внутричерепной эпидермоид, жемчужная опухоль) — опухолевидное образование, которое является результатом агрессивного роста ороговевающего плоскоклеточного эпителия, сместившегося в полость черепа или позвоночного канала в раннем периоде эмбрионального развития [1, 2, 3].
Проблема эпидермоидных кист головного мозга (ГМ) мало освещена в специализированной литературе в виду редкой встречаемости данной патологии (от 0,2 % до 1,8 % от всех первичных опухолей ГМ), что приводит к возникновению трудности дифференциальной диагностики с другими новообразованиями [4, 5]. Причиной возникновения большинства ЭК является нарушение закладки нервной трубки на 3–5-й нед внутриутробного развития, что позволяет рассматривать их как патологию дизэмбриогенеза [6]. Большинство работ отечественных и зарубежных исследователей посвящены изучению аспектов хирургического лечения холестеатом височной кости и изложены в научных трудах оториноларингологов. В основном страдает население работоспособного возраста 20–40 лет, чаще мужской пол. ЭК спинного мозга наблюдается преимущественно у детей, иногда в сочетании с пороками развития нервной системы [7, 8, 9].
Холестеатома имеет вид одиночного узла неправильно округлой формы с неравномерной бугристой поверхностью. Опухоль медленно растет, заполняет подпаутинные цистерны или вдавливаясь в вещество ГМ, плотно срастаясь с ним. Макроскопически это однокамерная, реже многокамерная киста с белым пластинчатым хрупким содержимым, состоящим из ороговевших эпителиальных клеток и кристаллов холестерина, придающих массе сальный вид [10, 11, 12].
При гистологическом исследовании капсула эпидермоидной кисты состоит из двух слоев: наружного, образованного тонким слоем волокнистой соединительной ткани, и внутреннего — тонкого пласта многослойного плоского эпителия [13]. Наружный слой обычно плотно спаян с прилежащим веществом ГМ и иногда содержит инфильтраты из лимфоцитов и плазматических клеток. Внутренний слой соответствует редуцированной структуре эпидермиса, состоящего из одного-двух рядов клеток росткового, зернистого и рогового слоев. Когда ороговевшие массы непосредственно прилежат к наружному слою, в нем развивается хроническое продуктивное воспаление [10, 11, 14].
По данным литературы выделяют [9, 15, 16, 17, 18, 19]:
1. Внутричерепные холестеатомы
• мостомозжечкового угла (ММУ) (40,4 % всех случаев ЭК);
• турецкого седла и хиазмальной области (10–23,1 % всех случаев ЭК);
• желудочков ГМ (11,5 % всех случаев ЭК);
• височной кости и в области среднего уха (17,3 % всех случаев ЭК);
• костей свода черепа (7,7 % всех случаев ЭК).
2. Ложные холестеатомы (развиваются в результате разрастания эпидермиса в среднем ухе при длительном воспалении).
3. Спинномозговые холестеатомы.
4. Вторичные холестеатомы (развиваются при открытых повреждениях черепа и транскраниальных оперативных вмешательствах).
Отдельно среди вторичных ЭК выделяют постпункционные холестеатомы, развивающиеся в результате смещения эпидермиса во время люмбальных пункций [17, 18].
Клиническая картина холестеатом ГМ зависит от их локализации и особенностей направления роста.
Частота рецидивов ЭК составила 4,4 %, продолженного роста — 15,6 %. Факторами, влияющими на возникновение рецидивов, являются инвазивный рост опухоли и радикальность их резекции [20, 21, 22].
Возможно злокачественное перерождение данных новообразований в плоскоклеточный рак, значительно снижающая продолжительность жизни пациентов [23, 24].
Единственным эффективным методом лечения холестеатом является хирургическое удаление [17, 21]. Современные хирургические и радиологические технологии позволяют добиться благоприятных результатов. Однако возможность тотального удаления ЭК из ММУ должна рассматриваться осторожно, с учетом эффективности радикального удаления и риска хирургических осложнений [25, 26, 27].
Цель исследования: представить клинический случай из практики, а также современный подход к диагностике и лечению холестеотом ГМ, в частности ЭК мосто-мозжечкового угла (ММУ).
Материалы и методы
Объектами данного исследования являются клинический случай внутричерепной холестеотомы ММУ. Предмет исследования — особенности клинических проявлений, диагностики, хирургической тактики лечения холестеотом ММУ.
Для динамического наблюдения использовался диагностический нейрохирургический комплекс, включающий общеклиническое обследование, оценка неврологического статуса и данные нейровизуализации — компьютерной томографии (КТ) и магнитно-резонансной томографии (МРТ).
Клиническое наблюдение
Больной Б., 32 года, поступил в нейрохирургическую клинику Городской клинической больницы № 39 г. Нижнего Новгорода с жалобами на слабость, головокружение, периодическую икоту, шаткость походки, снижение слуха справа.
Считает себя больным в течение двух месяцев, когда у пациента появилась слабость, боль в правой половине лица. Лечился амбулаторно с некоторым положительным эффектом. Выполнил МРТ ГМ, выявлено объемное образование правого ММУ.
В неврологическом статусе при поступлении: в сознании, ориентирован. Зрачки D=S, фотореакция сохранена, слабость отводящих нервов с обеих сторон. Мелкоразмашистый горизонтальный нистагм при взгляде в обе стороны. Лицо симметрично. Легкая гипестезия правой половины лица. Голос с гнусавым оттенком. Глотание не нарушено. Икота. Язык по средней линии. Некоторое угнетение рефлексов с мягкого неба и задней стенки глотки. Сухожильные рефлексы оживлены D=S, активные движения во всех конечностях, сила 5 баллов. Патологических и менингеальных знаков нет. В позе Ромберга покачивается без видимой сторонности. Координационные пробы выполняет неуверенно, с интенцией.
МРТ ГМ с внутривенным контрастированием (рис. 1): МР-картина объемного образования правого ММУ, которое оказывает выраженный масс-эффект, компрессию продолговатого мозга, правую гемисферу мозжечка, Варолиев мост, 4-й желудочек, ножки ГМ со смещением описанных структур влево на 1,0 см. Данное объемное образование охватывает базилярную артерию и начальные отделы ЗМА с обеих сторон. Тройничный нерв оттеснен кнаружи, деформирован. После введения контрастного вещества выявляется слабое усиление МР-сигнала по периферии данного образования.
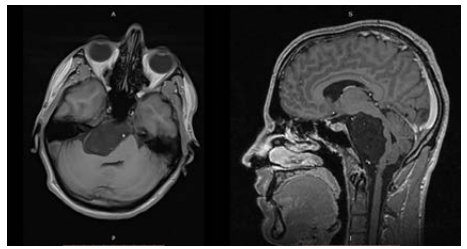
Рисунок 1. МРТ головного мозга пациента Б., 32 года
Лечение — выполнена операция: костно-пластическая трепанация лобной области, микрохирургическое удаление опухоли боковых желудочков с применением нейронавигации.
По данным КТ ГМ в послеоперационный период: состояние после КПТ черепа в лобной области, незначительный геморрагический субстрат в задних рогах боковых желудочков, пневмоцефалии.
Патогистологическое заключение: ЭК.
Динамика: послеоперационный период без осложнений, послеоперационная рана зажила первичным натяжением, нарастания неврологической симптоматики не выявлено. Выписан в стабильном удовлетворительном состоянии на амбулаторное лечение.
Результаты и обсуждение
Проведена оценка отдаленных результатов нейрохирургического лечения. У двоих прооперированных отмечался значительный регресс предоперационной симптоматики, оба вернулись к прежней работе. При неврологическом осмотре выявлены умеренные остаточные неврологические проявления в виде легких координационных нарушений.
Эпидермоидная киста была впервые описана J. Cruveilhier (1829). Dandy W. (1945) называл ее «самой красивой опухолью тела» [28, 29, 30, 31].
Клиническая картина холестеатом ММУ развивается длительно в два года и больше, симптоматика обычно невыраженная, включающую атаксию, нистагм, прозопалгии, парестезии, слабость в конечностях [11, 27, 32]. Наиболее типичные симптомы заболевания — парезы лицевой мускулатуры и снижение слуха из-за сдавления внутри эпидермоида VII и VIII нервов и нарушения кровообращения в них. ЭК ММУ могут вызывать невралгию тройничного нерва, атипичные лицевые боли, невралгию языкоглоточного нерва, лицевой гемиспазм, болезненные тики [32, 33, 34].
Разрыв эпидермоидной кисты является редким, но тяжелым осложнением, обусловливающим ремиттирующее течение асептического или химического менингита за счет раздражения арахноидальной оболочки и черепных нервов протеиновыми дериватами [20, 27].
Существенные трудности диагностики ЭК — это дифференциация их содержимого со спинномозговой жидкостью и дифференциация ЭК с другими новообразованиями ММУ: арахноидальными кистами, менингиомами, а также метастазами (чаще рак легкого, молочной железы, меланома), вестибулярными шванномами, липомами, лимфомами, саркоидозом, туберкулезом, аневризмой, каверномой, хордомой, хондросакромой, гемангиобластомой, медуллобластомой, параганглиомой, глиомами и др. (табл. 1).
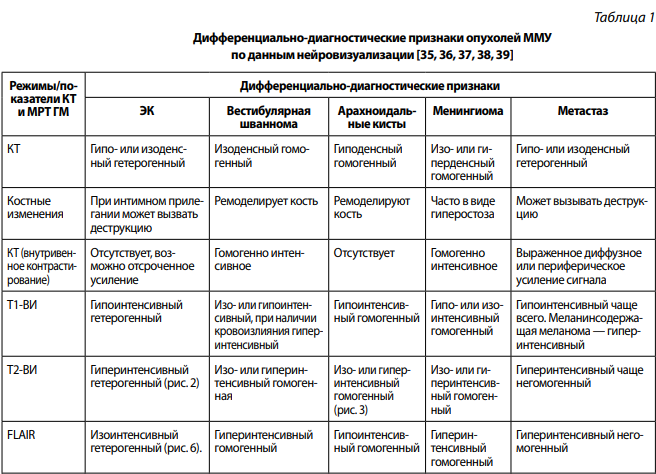
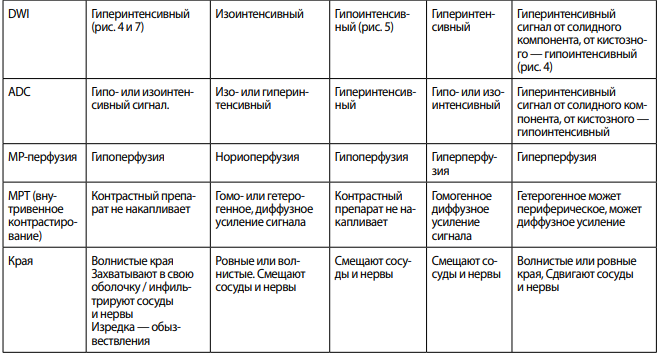
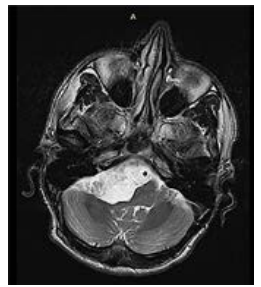
Рисунок 2. КТ-картина в Т2-режиме ЭК правого ММУ
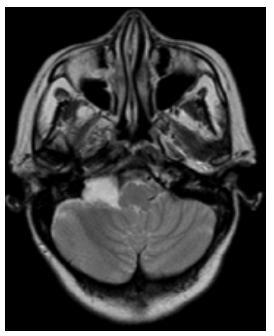
Рисунок 3. КТ-картина в Т2-режиме арахноидальная киста правого ММУ
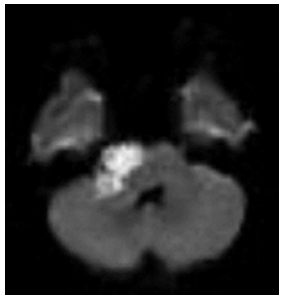
Рисунок 4. КТ-картина в DWI-режиме ЭК правого ММУ
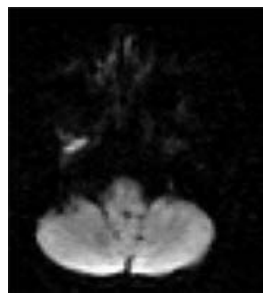
Рисунок 5. КТ-картина в DWI-режиме арахноидальная киста правого ММУ
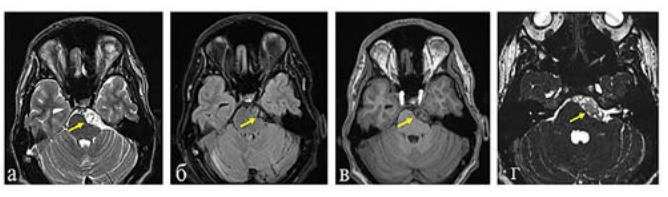
Рисунок 6. МРТ головного мозга с изображением ЭК: а) Т2-ВИ (образование, имеющее неоднородный гиперинтенсивный сигнал); б) FLAIR (образование имеет неоднородный изоинтенсивный сигнал); в) Т1-ВИ (образование имеет неоднородный изоинтенсивный сигнал); г) CISS) толщина сера 0,6 мм (вид структуры ЭК)
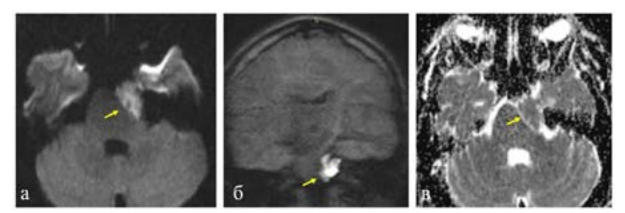
Рисунок 7. МРТ головного мозга в режиме DWI с изображением ЭК: а) диффузионно-взвешенное изображение (b=1000) аксиальная плоскость (образование имеет высокий сигнал); б) диффузионно-взвешенное изображение (b=1000) корональная плоскость; в) ADC карта (МР — сигнал от образования изоинтенсивный)
Karantanas А. Н. et. al. описали преимущества использования FLAIR для визуализации внутричерепных ЭК. В серии из восьми пациентов, которым проводился FLAIR-режим, выявлялся более высокий контраст между образованием и ликвором. Тем не менее ряд авторов отмечают, что режим FLAIR мало информативен в препонтинной зоне и базальных цистернах вследствие большого объема ликвора и образования артефактов [37].
Основным методом лечения ЭК является радикальная нейрохирургическая операция, а радиотерапия и химиотерапия неэффективны [25, 26, 27, 29].
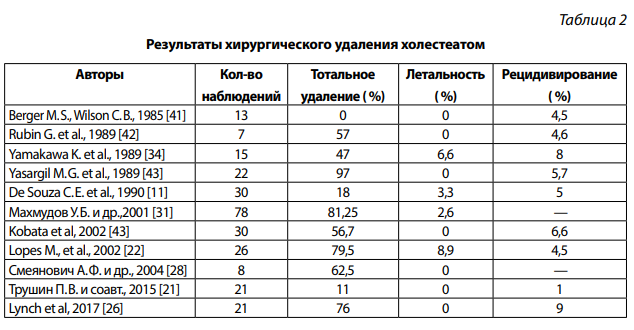
С момента появления микрохирургической техники послеоперационные осложнения и смертность от удаления ЭК заметно снизились за последние 20 лет (табл. 2) [15]. Имеются следующие этапы хирургического удаления ЭК: нейрохирургический доступ; оценка соотношения ЭК с нервами и сосудами данного анатомического региона; вскрытие капсулы с интракапсулярным ее уменьшением в объеме и последующим удалением всей массы ЭК; отделение капсулы холестеатомы от черепных нервов и сосудов; тщательная ревизия зоны оперативного вмешательства с удалением оставшихся частей опухоли и отмыванием ложа удаленной опухоли с целью профилактики развития в послеоперационном периоде менингита. Арахноидальные цистерны основания черепа служили нейрохирургу дополнительными ориентирами при резекции ЭК. Двигаясь в медиальном направлении при удалении, достигается ствола ГМ, при этом последовательно выделялись черепные нервы акустико-фациальной и каудальной групп. До появление операционного микроскопа, операционная смертность колеблется от 20 % до 57 %. Увеличился объем (радикальность) удаляемого новообразования. Практика показала, что не всегда производится полное удаление ЭК вместе с капсулой. Описаны случаи, когда оставлялись мелкие фрагменты капсулы [15, 17]. Иногда это оправдывалось целью уменьшения риска хирургической катастрофы, т. к. капсула сращивалась с нейроваскулярными структурами. В то же время, тонкая капсула ЭК не всегда отчетливо дифференцируется даже при значительном оптическом увеличении, нередко она удаляется вместе с фрагментами арахноидальной оболочки [27, 32].
Кроме того, ЭК могут вовлекать в себя каудальные черепные нервы с 2-х сторон и их поражение, даже временное, влечет за собой развитие таких грозных осложнений, как бульбарный синдром и аспирационная пневмония [20, 26, 31].
В хирургии холестеатом ММУ наиболее оптимальным следует считать ретросигмовидный субокципитальный доступ. Парамедианный доступ использован при распространении ЭК в область краниовертебрального перехода. У больных с распространением ЭК ММУ в среднюю черепную ямку и на дорсальную поверхность ската применена двухэтапная тактика хирургического лечения (субтемпоральный и птериональный доступы).
Основные послеоперационные осложнения — это послеоперационной ликворея и асептический менингит, возникающий в связи с химическим раздражением субарахноидальных пространств содержимым ЭК [21, 22].
Частота асептического или химического менингита в результате разрыва оболочки ЭК достигает более 22 % [17, 44]. Чтобы предотвратить это осложнение, нейрохирурги предлагают проводить по возможно тотальное удаление опухоли и во время операции обильно ирригировать хирургическое поле раствором гидрокортизона (100 мг на литр раствора рингера лактата) [11, 20, 26]. В послеоперационном периоде для закрепления эффекта назначают глюкокортикостероиды и антибактериальные препараты и проводят санационные люмбальные пункции. Назначают дексаметазон в дозировке 16 мг внутримышечно (8 мг — утром, 8 мг — днем) в течении 14 дней и в проведении ежедневных люмбальных пункций. При развитии выраженных воспалительных явлений рекомендуется эндолюмбальное введение глюкокортикостероида [21]. Для типичной клинической картины асептического менингита характерны повышение температуры тела, менингеальный синдром, воспалительные изменения в крови и ЦСЖ при отрицательных результатах бактериологического исследования. Продолжительность этих явлений, по данным некоторых авторов, составляет 2–3 недели. В свою очередь асептический менингит может привести к развитию окклюзионной гидроцефалии, что требует проведения ликвородренажных и ликворошунтирующих операций [21].
Важнейшей проблемой лечения ЭК являются рецидивы опухоли, частота которых составляет 4,5–9 % (табл. 2). Причиной рецедивирования, по данным зарубежных авторов является миграция паренхиматозных элементов эпидермоидной кисты по ходу операции [11, 20, 23, 24, 26, 37]. Диагностика рецидива холестеатом является трудной задачей в виду отсутствия специальных признаков при проведении КТ и МРТ в стандартных режимах [35, 36, 37, 38, 39]. Повторные операции при рецидивных ЭК показаны лишь в случаях нарастания у больных неврологического дефицита. Результаты повторных операций значительно хуже, чем первичных − возрастает летальность и частота послеоперационных осложнений [20, 21, 26, 30].
Заключение
ММУ является локализацией широкого ряда объемных образований: шванномы, невриномы, арахноидальной кисты, ЭК, артериальной аневризмы, метастазов и др. Нейрохирург перед проведением операции должен хорошо ориентироваться в нейровизуализации, данных анамнеза и клинической картины для оценки предполагаемого генеза объемного образования, так как каждая из них имеет тактические особенности ведения пациента.
Современные хирургические и радиологические технологии позволяют добиться благоприятных результатов лечения холестеатом [2, 5, 21, 26, 30]. Однако возможность тотального удаления ЭК из ММУ должна рассматриваться осторожно, с учетом эффективности радикального удаления и риска хирургических осложнений.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
CONFLICT OF INTEREST
The authors declare no conflict of interest.


